Annick M. E. Alleleyn
2 Divizia de Gastroenterologie-Hepatologie, Departamentul de Medicină Internă, Școala de Nutriție și Cercetare Translațională în Metabolism, Centrul Medical al Universității Maastricht +, P.O. Box 5800, 6202 AZ Maastricht, Olanda; [email protected] (D.K.); [email protected] (E.W.)
Mark van Avesaat
2 Divizia de Gastroenterologie-Hepatologie, Departamentul de Medicină Internă, Școala de Nutriție și Cercetare Translațională în Metabolism, Centrul Medical al Universității Maastricht +, P.O. Box 5800, 6202 AZ Maastricht, Olanda; [email protected] (D.K.); [email protected] (E.W.)
Dina Ripken
3 Organizația Olandeză pentru Cercetare Științifică Aplicată, TNO, P.O. Box 360, 3700 AJ Zeist, Olanda
4 Divizia de nutriție umană, Universitatea Wageningen, P.O. Caseta 17, 6700 AA Wageningen, Olanda
Sinéad B. Bleiel
5 AnaBio Technologies LTD., Centrul de inovare, Carrigtwohill, T45 RW24 Cork, Irlanda; [email protected]
Daniel Keszthelyi
2 Divizia de Gastroenterologie-Hepatologie, Departamentul de Medicină Internă, Școala de Nutriție și Cercetare Translațională în Metabolism, Centrul Medical al Universității Maastricht +, P.O. Box 5800, 6202 AZ Maastricht, Olanda; [email protected] (D.K.); [email protected] (E.W.)
Ellen Wilms
2 Divizia de Gastroenterologie-Hepatologie, Departamentul de Medicină Internă, Școala de Nutriție și Cercetare Translațională în Metabolism, Centrul Medical al Universității Maastricht +, P.O. Caseta 5800, 6202 AZ Maastricht, Olanda; [email protected] (D.K.); [email protected] (E.W.)
Freddy J. Troost
2 Divizia de Gastroenterologie-Hepatologie, Departamentul de Medicină Internă, Școala de Nutriție și Cercetare Translațională în Metabolism, Centrul Medical al Universității Maastricht +, P.O. Caseta 5800, 6202 AZ Maastricht, Olanda; [email protected] (D.K.); [email protected] (E.W.)
6 Inovație și sănătate alimentară, Centrul pentru alimentație sănătoasă și inovare alimentară, Universitatea Maastricht, 5911 AA Venlo, Olanda
Henk F. J. Hendrix
Adrian A. M. Masclee
2 Divizia de Gastroenterologie-Hepatologie, Departamentul de Medicină Internă, Școala de Nutriție și Cercetare Translațională în Metabolism, Centrul Medical al Universității Maastricht +, P.O. Box 5800, 6202 AZ Maastricht, Olanda; [email protected] (D.K.); [email protected] (E.W.)
Abstract
Activarea frânei intestinale prin infuzarea substanțelor nutritive în intestinul subțire distal cu catetere inhibă aportul de alimente și sporește sațietatea. Incapsularea macronutrienților, care protejează împotriva digestiei în tractul gastrointestinal proximal, poate fi o alternativă neinvazivă pentru a activa această frână. În acest studiu, investigăm efectul ingestiei orale a unui amestec încapsulat de cazeină și zaharoză (activ) care vizează intestinul subțire distal față de un produs de control conceput pentru a fi eliberat în stomac asupra aportului de alimente, sațietate și concentrațiilor plasmatice de glucoză. Cincizeci și nouă de voluntari au primit produsul activ și de control în două zile de test separate. Aportul alimentar a fost determinat în timpul unei mese ad libitum la 90 de minute după ingestia produsului testat. Scorurile vizuale la scară analogică pentru sațietate și probele de sânge pentru analiza glucozei au fost colectate la intervale regulate. Ingerarea produsului activ a scăzut aportul alimentar comparativ cu produsul de control (655 kcal comparativ cu 699 kcal, respectiv, p Cuvinte cheie: sațietate, amestec de nutrienți încapsulați, eliberare distală, carbohidrați, proteine, supraponderalitate, gestionarea greutății
1. Introducere
Frâna intestinală constă dintr-un mecanism de feedback negativ de la părțile distale la cele mai proximale ale tractului gastrointestinal (GI) și este activată de macronutrienții intraluminali și de produsele lor digestive. Această frână controlează nu numai motilitatea și secreția GI, ci și aportul de alimente și sentimentele de sațietate [1,2,3]. Anterior, s-a demonstrat că toate tipurile de macronutrienți sunt capabili să activeze această frână intestinală și astfel să influențeze comportamentul alimentar [4]. În timp ce toate părțile intestinului subțire (duoden, jejun și ileon) sunt capabile să activeze această „frână intestinală”, frâna ileală este considerată a induce cele mai puternice semnale de feedback în controlul consumului de alimente și al sațietății [5,6]. Prin urmare, activarea ileală a frânei a apărut ca o țintă potențială de reducere a aportului caloric și, pe termen lung, pentru controlul greutății [7].
Până în prezent, activarea frânei intestinale la om a fost studiată în principal prin intubație intestinală, care este prin poziționarea cateterelor de hrănire nazo-intestinale pentru a infuza substanțe nutritive direct în intestinul subțire [4,5]. Aceste studii au furnizat dovezi clare că infuzia de cantități mici de grăsimi, proteine sau carbohidrați în intestinul subțire distal reduce aportul de alimente și crește sațietatea. Pentru aplicații clinice, ar trebui dezvoltate alte strategii mai puțin invazive pentru livrarea macronutrienților în intestinul subțire.
Schellekens și colab. și Varum și colab., ambele au conceput cu succes sisteme pentru livrarea de medicamente țintite și specifice locului în tractul gastrointestinal [8,9]. O abordare comparabilă poate fi utilizată pentru livrarea țintită de nutrienți. Incapsularea substanțelor nutritive cu un strat alimentar asigură o barieră împotriva digestiei în tractul GI proximal și este considerată o alternativă neinvazivă pentru livrarea țintită a nutrienților. Studiile anterioare au utilizat un produs de emulsie de ulei (Fabuless ®, Olibra ®) care vizează o livrare mai distală de grăsime. Aceste produse s-au bazat pe proprietățile fizico-chimice specifice unui emulgator [10,11,12]. Mecanismul propus pentru Fabuless este activarea frânei ileale; uleiurile emulsionate întârzie lipoliza și absorbția grăsimilor din tractul GI proximal și, prin urmare, expun tractul GI distal la un conținut ridicat de grăsime intraluminală. S-a demonstrat că Fabuless scade aportul de alimente și crește sațietatea în studiile realizate de Burns și colab. [7,8,9], deși acest lucru nu a fost confirmat de alții [13,14,15,16]. S-a emis ipoteza că prelucrarea alimentelor ar fi putut diminua capacitatea Fabuless de a livra grăsimi nedigerate în intestinul subțire distal [16].
Acest studiu de dovadă a conceptului a avut ca scop investigarea efectului acut al unui amestec de nutrienți încapsulați administrat oral, vizând eliberarea intestinală mai distală, asupra aportului de hrană și a sațietății, comparativ cu un produs de control care se dezintegrează în stomac la subiecții sănătoși supraponderali. Am emis ipoteza că amestecul de nutrienți încapsulați induce mai puternic sațietate și reduce consumul de alimente în timpul unei mese ad libitum comparativ cu starea de control. Am administrat doi macronutrienți: proteine (cazeină) și carbohidrați (zaharoză). Am ales să nu administrăm grăsime, deoarece administrarea unor cantități semnificative de grăsime în ileonul distal poate duce la disconfort GI [17,18]. În plus, grăsimea necesită o tehnică de încapsulare diferită în comparație cu carbohidrații și proteinele [19].
2. Materiale și metode
Studiul a fost aprobat de Comitetul de Etică Medicală al Centrului Medical al Universității Maastricht + și a fost realizat în deplină conformitate cu principiile Declarației de la Helsinki din 1975, astfel cum a fost modificată în 2013, și cu Regulamentele olandeze privind cercetarea medicală care implică subiecți umani (1998) . Toți subiecții au dat consimțământul scris în scris înainte de participare. Acest proces a fost înregistrat la www.clinicaltrials.gov ca> NCT02635659.
2.1. Subiecte
Subiecții au fost recrutați între decembrie 2015 și iunie 2016. Voluntarii sănătoși erau eligibili să participe dacă aveau vârsta cuprinsă între 18 și 65 de ani și aveau un indice de masă corporală (IMC) cuprins între 25 și 30 kg/m 2. Voluntarii au fost recrutați prin reclame locale. Criteriile de excludere au fost consumul a mai mult de 20 de consumuri alcoolice pe săptămână, utilizarea specifică a medicamentelor sau istoricul medical al oricărei tulburări relevante sau intervenții chirurgicale care ar putea interfera cu rezultatele studiului (așa cum a fost evaluat de un medic), simptome GI cunoscute și regimul alimentar. Toți subiecții au raportat o greutate stabilă timp de cel puțin 6 luni înainte de screening și au fost consumatori neîngrădite (evaluat prin chestionarul olandez de comportament alimentar [20]) și au raportat că nu urmează o dietă în timpul perioadei de studiu. După furnizarea informațiilor inițiale verbal sau prin e-mail, au fost furnizate informații detaliate scrise de studiu în cazul în care subiecții erau interesați. Toți subiecții au trebuit să înțeleagă procedurile de studiu înainte de semnarea consimțământului informat. Consimțământul informat scris a fost obținut după un interval de cel puțin 7 zile.
Calculul puterii s-a bazat pe scăderea aportului alimentar de 136 kcal constatată în studiul de perfuzie ileală cu carbohidrați efectuat de grupul nostru [4]. Ne așteptam să găsim o scădere de 50%, care să corespundă cu 68 kcal. Cu o abatere standard de 175 kcal, o putere de 80% și un alfa de 0,05, a fost necesar un număr total de 54 de subiecți. Anticipând o scădere de 10-15%, am inclus 62 de subiecți sănătoși.
2.2. Design de studiu
Acest studiu încrucișat dublu-orb, randomizat, controlat a comparat efectul unui amestec de nutrienți încapsulați care vizează intestinul subțire distal cu cel al unui produs de control identic (amestec de nutrienți cu încapsulare de alginat care se dezintegrează în stomac). Produsul studiat a fost ingerat 180 de minute după un mic dejun standard, pentru a permite golirea stomacului înainte de ingestia băuturilor testate. Zilele de testare au fost programate cu o perioadă de spălare de 1 săptămână între ele pentru a evita posibilele efecte de reportare. Zilele de testare au fost alocate aleatoriu (folosind Research Randomizer, www.randomizer.org). Subiecții au fost randomizați la tratament în moduri de blocuri randomizate. Factorii primari de randomizare au fost sexul și vârsta.
2.3. Produse de studiu
Produsul activ a fost un amestec de nutrienți încapsulați conținând 16 g zaharoză (4 kcal g -1, van Gilse Automatensuiker, Oud Gastel, Olanda), 10 g cazeină (densitate energetică: 3,45 kcal g -1, Dutch Protein Services, Tiel, Olanda) și 2 g de proteină din zer, care a fost utilizată pentru fabricarea microencapsulatului (AnaBio Technologies, densitatea energetică 112 kcal). Produsul de control conținea 16 g zaharoză și 10 g cazeină (AnaBio Technologies, densitate energetică 107 kcal). Macronutrienții din produsul martor au fost încapsulați cu un sistem de încapsulare alginat de sodiu caracterizat prin extrudarea micronutrienților respectivi folosind 1,8% (g/v) alginat de sodiu, cu uscare ulterioară. Probele au fost dizolvate într-un volum total de 80 ml apă înainte de consum. Băuturile au fost preparate de un cercetător independent și oferite într-o sticlă opacă neagră pentru a orbi atât investigatorul, cât și participantul.
2.4. Procedura de micro-încapsulare
Procedura de preparare a micro-capsulelor este descrisă în brevetul WO 2016/096931 A1 [21]. Toate materialele au fost produse în conformitate cu ghidurile de bună practică de fabricație (GMP). Sistemul de micro-încapsulare folosește surse de zaharoză și cazeină cu etichetă curată, de calitate alimentară, pentru a genera capsule de dimensiuni micronice pentru livrarea controlată a cazeinei native și zaharozei în intestinul subțire distal pentru stimularea mecanismului de frânare intestinală. Microcapsulele gastro-rezistente au fost produse atunci când formularea de zaharoză și cazeină a fost extrudată printr-un aparat cuprinzând o duză exterioară dispusă concentric în jurul unei duze interioare și în care o soluție de proteină denaturată este extrudată prin duza exterioară și cazeina care formează miezul —Soluția de zaharoză este extrudată prin duza interioară. Micro-picăturile au fost polimerizate instantaneu într-o soluție acidă și loturile au fost ținute la temperatura camerei pentru max. 1 h în condiții aseptice. Acest proces evită (1) blocarea zaharozei - soluției de cazeină în duza concentrică și (2) discrepanțelor de curgere în timpul procesului de încapsulare, care ar afecta eficiența încapsulării micro-capsulelor zaharoză-cazeină.
2.5. Caracterizarea microîncapsulatelor
2.5.1. Distribuția mărimii și efectele de uscare
Conform microscopiei cu lumină, micro-margele au demonstrat diametre de aproximativ 200 μm cu o distribuție de dimensiuni îngustă (± 1,2 μm). Difractometria laser a fost, de asemenea, încorporată și a confirmat o valoare D (ν, 0,9) pentru micro-încapsulate, dezvăluind un diametru de 201,7 ± 0,90 μm și 183,42 ± 0,90 μm, pre și post-uscare.
2.5.2. Incubația stomacului și rezistența microîncapsulatelor
Rezistența micro-bile a fost analizată în funcție de timpul de incubație gastrică in vivo (pH 1,2-1,4; 37 ° C). Nu s-a raportat nicio diferență în rezistența micro-mărgelei pentru incubația stomacului, iar afecțiunile stomacale activate de enzime nu au modificat semnificativ rezistența micro-mărgelei. Rezistența la tracțiune a micro-bile a rămas neschimbată, fără scurgeri sau pierderi raportate de cazeină încapsulată, proteină de mazăre sau zaharoză. După 180 de minute de incubație gastrică, cazeina încapsulată, proteina de mazăre și microîncapsulatele de zaharoză au menținut o rezistență ridicată la tracțiune 52,03 ± 1,27 nN, 60,31 ± 0,27 nN și respectiv 58,23 ± 0,12 nN pentru a susține un sistem de încapsulare robust și cu randament ridicat pentru macronutrienți.
2.5.3. Incubația și degradarea intestinală
Timpul de tranzit al microîncapsulatelor a fost investigat în timpul studiilor in vivo și au observat că 35 de minute după ingestia orală nu a existat nici o degradare a microîncapsulatelor din duoden. Menținerea integrității micro-încapsulate în fluidele intestinului subțire a fost testată și degradarea nu a fost evidentă. Pe măsură ce timpul a progresat, membrana capsulată se degradează treptat pentru a elibera materialul de bază mononuclear [21].
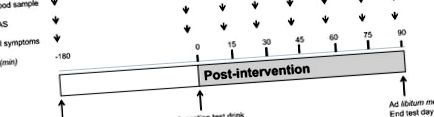
2.6. Protocol
Cronologia zilei testului. O băutură de testare (amestec de nutrienți încapsulați sau martor) a fost ingerată 180 de minute după terminarea micului dejun. Probele de sânge, scorurile VAS pentru sațietate și scorurile simptomelor GI au fost colectate la intervale regulate, după cum se indică.
2.7. Scorurile VAS pentru sațietate, plenitudine, dorința de a mânca, foamea și evaluarea simptomelor GI
Sațietatea, foamea, plinătatea și dorința de a mânca au fost măsurate folosind scoruri VAS (0-100 mm) ancorate la capătul inferior cu cele mai negative dintre cele mai mici intensități (extrem de neplăcute, deloc) și cu termenii opuși la cel mai înalt final (extrem de plăcut, foarte înalt, extrem) [22]. Simptomele gastrointestinale au fost evaluate utilizând un chestionar care abordează reclamații precum greață, balonare, cefalee și alte simptome. Simptomele au fost punctate pe o scară de 4 puncte, cu gradul 0 reprezentând „neprezent” la 3 „puternic prezent”. Subiecții au fost rugați să marcheze scorurile simptomelor VAS și GI înainte de consumul micului dejun. Aceasta a fost considerată ca t = -180 min. Subiecții au marcat, de asemenea, scorurile simptomelor VAS și GI înainte de ingestia băuturii testate. După ingestia băuturii testate (între t = 0 min și t = 90 min), simptomele VAS și GI au fost punctate la intervale de 15 min până la începerea mesei de prânz ad libitum.
2.8. Colectarea probelor de sânge
Probele de sânge venos au fost extrase înainte de micul dejun (post) și înainte de ingestia băuturii testate (t = 0 min). După ingestia băuturii testate, s-au obținut probe de sânge la fiecare 15 minute până la începutul mesei ad libitum (t = 90 min) pentru analiza glucozei. Concentrațiile de glucoză au fost analizate ca un indicator indirect pentru locul de livrare a nutrienților și absorbția ulterioară a nutrienților. Tuburile de fluorură de sodiu (Becton și Dickinson, NJ, SUA) au fost utilizate pentru a colecta probe de sânge pentru concentrațiile plasmatice de glucoză. Măsurătorile glucozei au fost efectuate folosind un analizor Roche Cobas C701 (GLUC3, Roche, Mannheim, Germania) cu o variație inter-test de 0,02 mmoL/L la concentrația de glucoză 3,27 mmoL/L.
2.9. Analize statistice
- Utilizarea revendicării privind conținutul de substanțe nutritive cu conținut scăzut de grăsimi Ghidurile FDA trebuie să fie cunoscute de producătorii de alimente
- Impactul creșterii prețului alimentelor asupra aportului caloric din China
- Efectul educației nutriționale asupra cunoașterii, atitudinii și performanței despre junk food
- Efectul nutriției și igienei educației alimentare asupra cunoștințelor școlii elementare feminine
- Alimente irosite, pierderi de nutrienți irosiți din pierderea de nutrienți din alimentele irosite din Statele Unite și comparație cu