Abstract
fundal
Obezitatea este una dintre principalele amenințări la adresa sănătății publice globale. Este în consecință metabolismul energetic anormal. În prezent, s-a stabilit bine că expunerea maternă la factorii de stres din mediul înconjurător care cauzează o dezvoltare fetală inadecvată poate avea efecte adverse pe termen lung asupra metabolismului energetic al descendenților într-o manieră dependentă de sincronizarea expunerii, cunoscută sub numele de programarea dezvoltării paradigmei sănătății și bolilor. Dovezi în creștere rapidă au indicat faptul că expunerea maternă la particule fine ambiante (PM2.5) se corelează cu dezvoltarea fetală anormală. În studiul de față, am evaluat, prin urmare, dacă expunerea maternă la motorina de evacuare PM2.5 (DEP), componenta majoră a PM2.5 ambientală în zonele urbane, programează metabolismul energetic al descendenților și am examinat în continuare modul în care timpul expunerii are impact asupra acestei programări.
Rezultate
Concluzie
Maternitatea prenatală și postnatală de către barajele expuse la DEP programează în mod diferențiat metabolismul energetic al descendenților, subliniind luarea în considerare a momentului expunerii atunci când se examinează efectele adverse ale expunerii materne la PM2,5 din mediul ambiant.
fundal
În plus față de perioada de gestație, copilăria sa dovedit a fi vulnerabilă la programarea dezvoltării de către factorii de stres de mediu [2]. Mai mult, mai multe studii au indicat că momentul expunerii la factorul de stres al mediului determină nu numai severitatea, ci și natura programării de dezvoltare [2]. De exemplu, expunerea maternă la foamete în perioada de gestație timpurie are ca rezultat creșterea indicelui de masă corporală (IMC), în timp ce expunerea la foamete în perioada de gestație târzie și timpurie duce la scăderea IMC [21]. Interesant este faptul că, în timp ce mai multe studii au demonstrat efecte negative asupra sănătății ale expunerii gestaționale la PM2.5, așa cum s-a menționat mai sus, puține studii au investigat dacă maternitatea postnatală de către barajele expuse PM2.5 programează boli ale descendenților.
Având în vedere că atât poluarea cu PM2.5, cât și obezitatea vor continua să fie principalele probleme de sănătate în viitorul previzibil, sunt necesare studii suplimentare pentru a documenta programarea de dezvoltare a metabolismului energetic prin expunerea maternă la PM2.5 și dependența acestuia de sincronizare. În studiul de față, am examinat, prin urmare, efectele pe termen lung ale maternității prenatale și postnatale de către barajele de eșapament diesel expuse PM2.5 (DEP) asupra dezvoltării descendenților și asupra metabolismului energetic. Rezultatele noastre au arătat în mod neașteptat o programare diferită de dezvoltare a metabolismului energetic prin maternitatea prenatală și postnatală a barajelor expuse la DEP și, astfel, nu numai că au ridicat mai multe probleme de sănătate cu privire la expunerea maternă la PM2,5, dar au subliniat și luarea în considerare a momentului expunerii atunci când se examinează efectele asupra sănătății. a expunerii materne la poluanții atmosferici.
Metode
Animale
Universitatea din Maryland, Baltimore (UMB) este o instituție acreditată AAALAC. Toate procedurile acestui studiu au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor (IACUC) de la UMB și toate animalele au fost tratate uman și în ceea ce privește ameliorarea suferinței. Șoarecii C57Bl/6j (în vârstă de 4 săptămâni, 12 bărbați și 12 femele) au fost achiziționați de la Laboratoarele Jackson (stoc # 000664) și au fost adăpostiți în facilități pentru animale de la UMB, care au menținut lumina de 12 ore/lumină întunecată de 12 ore ciclu și temperatura și umiditatea în limitele recomandate. Cuștile de reproducere au fost înființate cu un bărbat și o femeie la vârsta de 12 săptămâni. Descendenții au fost înțărcați odată cu vârsta de 3 săptămâni.
Instilație intratraheală DEP maternă
Analiza traiectoriei de creștere a descendenților și a aportului de alimente
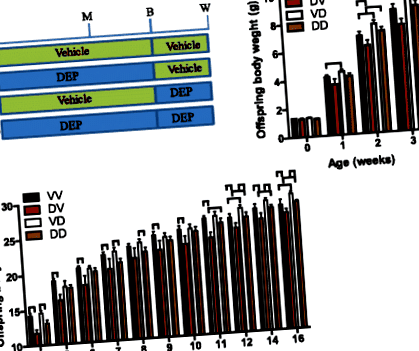
Greutățile corporale ale descendenților au fost măsurate săptămânal de la naștere până la vârsta de 16 săptămâni. Evaluarea consumului de alimente a fost efectuată la vârsta de 18-20 de săptămâni. Pe scurt, fiecare șoarece a fost găzduit într-o cușcă normală, iar greutatea dietei a fost înregistrată zilnic timp de 7 zile consecutive. Aportul alimentar a fost calculat ca diferență între două zile consecutive. A fost prezentat aportul mediu de alimente din ultimele cinci zile. Toți descendenții au fost eutanasiați la vârsta de 20-22 de săptămâni.
Analiza histologică
Țesutul adipos epididimal și țesutul adipos maro (BAT) au fost fixate în paraformaldehidă de 4%, încorporate în parafină, tăiate în secțiuni de 5 μm și colorate cu hematoxilină și eozină. Secțiunile de histologie au fost vizualizate la o mărire de 20 ×, iar imaginile au fost obținute cu o cameră digitală SPOT (Diagnostic Instruments, Sterling Heights, MI) de către o persoană care era orbă de grupare. Numărul total și secțiunile transversale ale adipocitelor din țesuturile adipoase epididimale au fost calculate așa cum s-a descris anterior. Zonele de picături de grăsime ale BAT au fost obținute utilizând software-ul Imagej, iar rezultatele au fost exprimate ca procent din suprafața totală.
RT-PCR în timp real
ARN-ul total a fost izolat din țesuturi (țesut adipos epididimal și hipotalamus) cu reactiv TRIzol (Invitrogen, Carlsbad, CA, SUA). 2 μg ARN total a fost transcris invers utilizând hexameri aleatori și sistemul ThermoScript RT-PCR (Invitrogen). RT-PCR cantitativ a fost efectuat cu Stratagene Mx3005 folosind SYBER Green PCR Master Mix (Applied Biosystems, Carlsbad, CA, SUA). Secvențele primerilor au fost prezentate în tabelul 1. Nivelul relativ de expresie a fost obținut așa cum s-a descris anterior [24]. Pe scurt, valorile Ct au fost cunoscute prin analiza cu software-ul furnizat de producător și s-au calculat diferențele valorii Ct între gena țintă și GAPDH (∆Ct) și apoi 2 ∆Ct.
Recoltarea țesuturilor, Western blot și evaluarea proteinelor din leptină
Animalele au fost postite peste noapte și i.p. injectat cu insulină (10 U/kg greutate corporală). După 20 de minute, animalele au fost eutanasiate prin supradozaj de izofluran. Sângele a fost colectat din inimă și centrifugat la 3000 rpm timp de 5 minute. Plasma a fost depozitată imediat în gheață uscată și apoi la -80 ° C. Hipotalamusul a fost izolat așa cum s-a descris mai înainte [25], apoi congelat rapid în azot lichid. Toate țesuturile au fost depozitate la -80 ° C până la prelucrarea ulterioară. Lizatele de țesut adipos maro au fost preparate folosind tampon RIPA (Sigma, St. Louis, MO) suplimentat cu inhibitori de protează și fosfatază (Sigma, St. Louis, MO). Probele de proteine au fost apoi separate prin electroforeză pe gel SDS-poliacrilamidă 10% și electroblotate pe membrane de fluorură de poliviniliden. Proteina țintă a fost detectată de iepure UCP1 (Boster, CA). Anticorpii secundari conjugați cu peroxidază de hrean și reactiv de chemiluminescență (Amersham, Marlborough, MA) au fost folosiți pentru a vizualiza proteinele țintă. Densitățile benzilor de proteine țintă au fost determinate cu Cantitatea Unu 4.4.1 (Bio-Rad, Hercules, CA). Controlul intern, β-actina, a fost utilizat pentru a normaliza variațiile de încărcare.
Pentru a evalua expresia proteinei leptinei în țesutul adipos, lizatele au fost preparate din țesuturi adipose epididimale folosind tampon RIPA (Sigma, St. Louis, MO) suplimentat cu inhibitori de protează și fosfatază (Sigma, St. Louis, MO), și nivelurile lor de proteine leptină. au fost evaluate cu kit ELISA (RayBio Mouse Leptin ELISA Kit, RayBiotech) conform instrucțiunilor producătorului. Rezultatele au fost normalizate prin concentrația de proteine totale și prezentate ca procentaj al nivelului din grupul VV.
Statistici
Toate datele sunt exprimate ca mijloace ± SEM, dacă nu se specifică altfel. Testele statistice au fost efectuate folosind analiza varianței unidirecțională sau bidirecțională (ANOVA) urmată de corecția Bonferroni sau nepereche t-testați folosind GraphPad Prism (versiunea 5; Software GraphPad, La Jolla, CA, SUA). Nivelul de semnificație a fost stabilit la p
Rezultate
Programare diferențială de dezvoltare prin maternitate prenatală și postnatală a barajelor expuse la DEP
Pentru a documenta efectele pe termen lung ale expunerii materne la DEP asupra dezvoltării descendenților, barajele (șoareci femele C57/Bl6j) au fost tratați cu DEP sau vehicul de la vârsta de 5 săptămâni până la înțărcarea descendenților. Tabelul 2 arată că această expunere la DEP nu a modificat semnificativ greutatea corporală a barajelor. Deoarece atât perioadele prenatale, cât și cele postnatale s-au dovedit a fi vulnerabile la programarea dezvoltării [2], iar unul dintre obiectivele principale ale studiului de față este de a determina fereastra programării dezvoltării prin expunerea maternă la DEP, jumătate de descendenți au fost comutați între vehicul- și baraje expuse la DEP odată născute. Astfel, au existat patru grupuri de descendenți în total (Fig. 1a): VV, descendenți ai barajelor tratate cu vehiculul, postnatale, maternizate de barajele tratate cu vehiculul; DV, descendenți ai barajelor tratate cu DEP postnatale materne de barajele tratate cu vehiculul; VD, descendenți ai barajelor tratate cu vehicule, care au fost postnatale de către barajele tratate cu DEP; DD, descendenți ai barajelor tratate cu DEP postnatale maternizate de baraje tratate cu DEP. Comparațiile VV cu DV și VD cu DD au reflectat efectele maternității prenatale de către barajele expuse la DEP, în timp ce comparațiile VV cu VD și DV cu DD au relevat efectele maternității postnatale de către barajele expuse la DEP.
Efecte specifice organelor maternității prenatale și postnatale de către barajele expuse la DEP
Pentru a documenta în continuare efectele asupra dezvoltării maternității prenatale și postnatale de către barajele expuse la DEP, am măsurat greutățile principalelor organe/țesuturi ale descendenților la vârsta de 22 de săptămâni. Figura 2b-f arată că nici maternitatea prenatală și nici cea postnatală de către barajele expuse la DEP nu au influențat greutățile plămânilor, inimii, ficatului, rinichilor și testiculului la descendenții adulți. Figura 2g relevă faptul că maternitatea postnatală de către barajele expuse la DEP a redus semnificativ greutatea splinei la descendenții adulți. În timp ce a crescut semnificativ masa țesutului adipos maro (BAT, Fig. 2h), țesutul adipos epididimal (Fig. 2i) și țesutul adipos peri-renal (Fig. 2j). De asemenea, a rezultat o tendință de creștere a masei țesutului adipos subcutanat (Fig. 2k). În schimb, maternitatea prenatală de către barajele expuse la DEP a scăzut semnificativ masa BAT, a crescut semnificativ masa țesutului adipos epididimal și nu a modificat semnificativ greutatea niciunui alt organ/țesut testat.
Efectele adipoase ale maternității prenatale și postnatale de către barajele expuse la DEP
Maternitatea prenatală dar nu postnatală de către barajele expuse la DEP reduce consumul de alimente pentru descendenți
Maternitatea postnatală, dar nu prenatală de către barajele expuse la DEP crește albirea BAT a descendenților
BAT este țesutul termogen cheie care reglează consumul de energie. Așa cum se arată în FIG. 2g, maternitatea prenatală de către barajele expuse la DEP a scăzut semnificativ masa BAT, în timp ce maternitatea postnatală de către barajele expuse la DEP a crescut masa BAT. Studiile au arătat că, pe lângă masa sa, nivelul de „albire” a BAT, caracterizat prin acumularea de picături lipidice mari și disfuncție mitocondrială, reflectă reducerea cheltuielilor de energie. Figura 5a și b demonstrează că maternitatea postnatală de către barajele expuse la DEP a crescut semnificativ dimensiunea picăturilor de lipide (Fig. 5a) și, de asemenea, acumularea totală de picături de lipide în BAT (Fig. 5b). În concordanță cu modificările morfologice, maternitatea postnatală de către barajele expuse la DEP a scăzut semnificativ nivelul proteinei UCP1, proteina primară de decuplare mitocondrială a BAT. În schimb, maternitatea prenatală de către barajele expuse la DEP nu a modificat nici acumularea picăturilor lipidice, nici expresia UCP1 în BAT.
Discuţie
Principalele constatări din prezentul studiu includ că: 1) atât maternitatea prenatală, cât și cea postnatală, prin programe de baraje expuse la DEP, descendenți ai metabolismului energetic; 2) programarea metabolismului energetic de către aceștia este însă semnificativ diferită: în timp ce maternitatea prenatală de către barajele expuse la DEP duce la o pierdere în greutate, maternitatea postnatală de către barajele expuse la DEP are ca rezultat o creștere în greutate; 3) maternitatea prenatală prin baraje expuse la DEP a crescut în mod specific masa țesutului adipos epididimal prin hiperplazie, în timp ce maternitatea postnatală prin barajele expuse la DEP a crescut masa tuturor tampoanelor de grăsime testate prin hipertrofie; 4) în timp ce maternitatea prenatală prin baraje expuse la DEP programează echilibrul energetic al descendenților în principal prin reducerea consumului de alimente, maternitatea postnatală prin barajele expuse la DEP influențează echilibrul energetic al descendenților în principal prin inducerea albirii BAT.
Metabolismul energetic anormal este central în patogeneza numeroaselor boli precum obezitatea, diabetul și cancerul. Sa demonstrat că expunerea la poluarea ambiantă cu PM2.5 cauzează o varietate de anomalii în metabolismul energetic care pot contribui la patogeneza bolilor cardiometabolice [26]. Prezentul studiu relevă în continuare că expunerea maternă la DEP provoacă efecte marcate pe termen lung asupra metabolismului energetic al descendenților printr-o manieră dependentă de momentul expunerii. Întrucât DEP este un component important al PM2,5 ambiant în multe zone urbane, cum ar fi New York City [27], aceste date extind astfel în mod semnificativ înțelegerea efectelor metabolice ale energiei induse de poluarea ambiantă, dar provoacă și probleme de sănătate transgeneraționale cu privire la expunerea poluarea mediului ambiant.
În prezentul studiu, am demonstrat că expunerea la DEP care acoperă o perioadă de pre-concepție de 7 săptămâni și întreaga gestație nu a modificat semnificativ greutatea la naștere a descendenților, dar a condus la o pierdere în greutate observată încă de la două săptămâni după naștere. Acest lucru reproduce perfect studiul anterior de expunere la inhalare folosind DEP din aceeași sursă [28], validând metoda noastră de expunere în evaluarea toxicității DEP. Aceste date, totuși, sunt incompatibile cu un alt studiu de expunere la inhalare care arată că expunerea la DEP gestațional reduce greutatea la naștere a descendenților [13]. În special, DEP utilizat în acesta din urmă provine din surse diferite, sugerând că compoziția DEP poate juca un rol critic în determinarea efectelor sale asupra descendenților.
Din câte știm, prezentul studiu este primul care oferă traiectoria de creștere de la naștere la adult a descendenților mamați de baraje expuse la DEP. Extinzând cunoștințele anterioare [28], traiectoria creșterii arată că efectele asupra greutății corporale ale expunerii materne la DEP sunt de lungă durată. Acest lucru este perfect compatibil cu paradigma DOHaD [2]. Latența dintre expunere și boală/disfuncție este o altă componentă importantă a paradigmei DOHaD. În acord cu paradigma DOHaD, prezentul studiu arată o latență evidentă între expunerea maternă la DEP și o varietate de anomalii metabolice la descendenți. Ca atare, datele noastre reafirmă că expunerea maternă la DEP este un factor de stres al mediului pentru programarea dezvoltării bolilor cardiometabolice, ridicând îngrijorări mai serioase cu privire la efectele sale transgeneraționale.
Datele actuale arată că expunerea maternă prenatală la DEP a redus aportul alimentar al descendenților, dar nu albirea BAT, însoțită de scăderea expresiei hipotalamice a unui neuropeptid orexigenic NPY, sugerând că expunerea maternă prenatală la DEP poate programa în principal aportul de energie. Aceste date sunt în concordanță cu numeroase studii care arată că expunerea maternă la factorii de stres din mediul înconjurător exercită efecte metabolice energetice pe termen lung asupra descendenților prin programarea circuitelor hipotalamice care reglementează echilibrul energetic [21]. Sunt în curs de studii suplimentare pentru a identifica modificările structurale și/sau funcționale ale hipotalamusului care pot explica expresia redusă a NPY și a consumului de alimente.
Este deosebit de remarcabil faptul că, deși expunerea maternă prenatală la DEP a scăzut greutatea corporală a descendenților, aceasta a crescut paradoxal masa țesutului adipos epididimal. Aceste date sunt cumva în concordanță cu studiile de urmărire a genealogiei care arată că grupul de precursori adipocitari albi murini este în mare parte comisă prenatal sau chiar după naștere [30] și, prin urmare, justifică studii suplimentare pentru a examina natura insultei precursorilor adipocitelor cauzată de expunerea maternă prenatală la DEP . Interesant este faptul că prezentul studiu demonstrează, de asemenea, că efectul adipos al expunerii materne prenatale la DEP părea a fi specific țesutului adipos epididimal. Acest lucru amintește despre eterogenitatea originilor de dezvoltare ale adipocitelor [31], oferind o altă dovadă că expunerea maternă prenatală la DEP poate afecta procesul timpuriu al adipogenezei.
Deoarece nu s-a observat nicio hipertrofie, această masă crescută de țesut adipos epididimal pare a fi datorată în primul rând hiperplaziei. S-a arătat că numărul adipocitelor animale crește până la pubertate, dar este relativ constant în grăsimea matură [32, 33]. De departe, modul în care sunt reglate numerele de adipocite din grăsimea matură nu este încă pe deplin înțeles. Astfel, demonstrația hiperplaziei adipose induse de expunerea maternă la DEP la descendenții adulți oferă un model animal valoros pentru a investiga modul în care sunt reglementate numerele de adipocite din grăsimea matură.
În plus, datele prezente arată că maternitatea postnatală de către barajele expuse la DEP crește adipozitatea descendenților, care pare a fi în primul rând consecința hipertrofiei. În special, hipertrofia adipoasă este însoțită de expresia scăzută a mai multor markeri de adipogeneză. Acest lucru este perfect în concordanță cu studiile anterioare care arată că tratamentul cu diete bogate în grăsimi induce hipertrofie adiposă și, între timp, scade expresia markerilor adipogeneza [37]. Aceste date împreună sugerează că expresia scăzută a markerilor de adipogeneză poate fi consecința, dar nu cauza hipertrofiei. Prin urmare, sunt încă necesare studii suplimentare pentru a delimita mecanismele pentru această inducere a hipertrofiei adipoase de către maternitatea postnatală de către barajele expuse la DEP.
Concluzie
În concluzie, prezentul studiu demonstrează dependența de sincronizare a programării de dezvoltare prin maternarea barajelor expuse la DEP. Aceste diferite efecte pe termen lung ale maternității prenatale și postnatale de către barajele expuse la DEP subliniază luarea în considerare a momentului expunerii atunci când se examinează efectele adverse ale expunerii materne la PM2,5 din mediul înconjurător.
- TOC în timpul unei perioade prenatale sau postnatale TOC-UK
- Tendințele cursului de dietă postnatală și exerciții online
- Dieta și exerciții postnatale online (cursul Future Mom) - certificat CPD
- Hrana reală pentru sarcină Știința și înțelepciunea nutriției prenatale optime de Lily Nichols
- PTSD postnatal sau traume la naștere; Știri-Medical