Abstract
fundal
Dietele cetogenice și cu indice glicemic scăzut sunt eficiente în tratamentul crizelor rezistente la medicamente la copiii cu sindrom Angelman. Cunoașterea, mobilitatea, somnul și sănătatea gastro-intestinală sunt legate intrinsec de activitatea convulsivă și de calitatea generală a vieții. Dietele cetogenice și glicemice scăzute restricționează consumul de carbohidrați și stabilizează nivelul glicemiei. Dieta ketogenică induce cetoza, o stare metabolică în care corpurile cetonice sunt preferențial utilizate pentru combustibil. Utilizarea cetonelor exogene în promovarea cetozei în sindromul Angelman nu a fost studiată anterior. Formularea de studiu evaluată aici conține beta-hidroxibutiratul cetonic exogen pentru a deplasa rapid corpul către cetoză, rezultând o eficiență metabolică sporită.
Metode/proiectare
Acesta este un studiu de 16 săptămâni, randomizat, dublu-orb, controlat placebo, crossover pentru a evalua siguranța și tolerabilitatea unei formule nutriționale care conține cetone exogene. De asemenea, examinează potențialul cetonelor exogene de a îmbunătăți starea nutrițională a pacientului, care poate avea un impact asupra responsabilităților fiziologice, simptomatice și de sănătate ale vieții cu sindromul Angelman.
Discuţie
Acest manuscris prezintă rațiunea unui studiu conceput pentru a fi primul care furnizează date despre abordările nutriționale pentru pacienții cu sindrom Angelman care utilizează cetone exogene.
Înregistrarea procesului
ClinicalTrials.gov, ID: NCT03644693. Înregistrat la 23 august 2018. Ultima actualizare la 23 august 2018.
fundal
Sindromul Angelman (SA) a fost descris pentru prima dată în 1965 [1] și are o prevalență în populația generală de 1: 10.000–1: 24.000 [2,3,4]. Pierderea sau reducerea funcției materne UBE3A genă (proteina ubiquitin ligaza E3A) a fost identificat la sfârșitul anilor 1990 ca mecanism cauzal în majoritatea cazurilor [5, 6]. Pacienții cu SA au universal întârzieri de dezvoltare, inclusiv tulburări de vorbire și tulburări de mișcare [7]. Persoanele sunt de obicei descrise ca având o dispoziție fericită, cu râsuri frecvente. Optzeci la sută dintre pacienți prezintă, de asemenea, convulsii și toți indivizii cu SA au o electroencefalogramă dezordonată (EEG) [8, 9]. O mare parte din populație are, de asemenea, probleme de hrănire (75%) și alte plângeri gastrointestinale (GI) [7, 10]. Din păcate, AS nu are leac. Protocoalele tipice de tratament includ farmacoterapia pentru convulsii, terapii fizice și comportamentale și intervenții educaționale [11]. Cu toate acestea, aproximativ 77% din populația AS prezintă convulsii rezistente la tratament [8].
Epilepsia refractară a fost tratată cu succes cu abordări dietetice specializate, cum ar fi dietele ketogenice (KD), trigliceridele cu lanț mediu (MCT) și cele cu indice glicemic scăzut (LGIT); aceste diete au avut, de asemenea, succes în AS [12,13,14,15]. KD permite organismului să treacă de la metabolismul pe bază de carbohidrați la cel pe bază de grăsimi, stimulând astfel ketogeneza hepatică. Cetoza nutrițională este o stare în care nivelurile sanguine ale corpurilor cetonice sunt semnificativ peste linia de bază, de obicei> 0,5 mmol/L. Corpurile cetonice (acetoacetat și beta-hidroxibutirat (BHB)) sunt substraturi energetice utilizate de mitocondrii pentru a produce adenozin trifosfat și pot fi utilizate ca combustibili alternativi la glucoză de către creier, inimă și mușchii scheletici.
Rata ridicată de convulsii refractare, hrănire și probleme gastro-intestinale și tulburări severe de comunicare în SA duc la o nevoie medicală ridicată. Există provocări copleșitoare pentru a asigura diete adecvate care să servească nevoile complexe ale persoanelor cu SA. Abordările nutriționale care promovează utilizarea cetonelor de către organism ca combustibil alternativ pot îmbunătăți starea nutrițională generală și pot permite o strategie terapeutică dietetică liberalizată la persoanele cu SA și, prin urmare, să îmbunătățească calitatea vieții.
Se presupune că suplimentarea dietetică cu ingrediente ketogenice are un impact important asupra satisfacerii nevoilor nutriționale de cetoză ale pacienților cu SA. Suplimentele cetonice pot ajuta la realizarea și menținerea cetozei, pot îmbunătăți sănătatea nutrițională generală a pacientului în gestionarea simptomelor AS și pot îmbunătăți calitatea vieții pacienților și a familiilor acestora. Acest studiu este conceput ca primul care a evaluat siguranța și tolerabilitatea ingredientului ketogenic beta-hidroxibutirat la o populație de pacienți cu o rată ridicată de epilepsie refractară. Acest manuscris descrie rațiunea, metodele și importanța potențială a intervențiilor nutriționale bazate pe cetonă la copiii cu AS.
Obiective
Obiectivul principal al studiului este de a evalua tolerabilitatea unei formulări nutriționale care conține BHB la pacienții cu SA în vârstă de 4-11 ani pe o varietate de medii dietetice. Obiectivele secundare includ evaluarea cetozei atunci când se consumă formularea nutrițională și siguranța formulării nutriționale la pacienții cu SA. Aceste măsuri de rezultat au fost alese deoarece aceasta este o populație vulnerabilă, nonverbală, cu capacitate limitată de a comunica dificultăți cu tolerabilitate și probleme de siguranță. În plus, gradul de cetoză atins poate informa viitoarele studii pentru a evalua impactul benefic al stării nutriționale a pacientului asupra rezultatelor sănătății. Toate măsurile sunt evaluate la momentul inițial și la sfârșitul fiecărei perioade de intervenție de 4 săptămâni (placebo versus formulare de test).
Metode/proiectare
Populația și cadrul
Supravegherea și auditul suplimentar al procesului sunt oferite de Donna Herber, dr., Șef șef al Disruptive Nutrition, LLC, cu conferințe săptămânale cu membrii echipei de cercetare Vanderbilt. Întâlnirile în persoană sunt planificate trimestrial, cu audit de date semestrial. Un comitet consultativ medical și de cercetare a fost înființat și este format din experți independenți și lideri de opinie cheie. Comitetul se întrunește semestrial. Consiliul de monitorizare a siguranței datelor este discutat într-o secțiune separată a acestui protocol sub „Monitorizarea datelor”.
Pacienții sunt recrutați pe site-ul Nashville, Tennessee, la Universitatea Vanderbilt. Subiecții cu SA sunt recrutați prin practica investigatorului principal, recomandări medicale, informare prin intermediul rețelelor de socializare și grupuri de sprijin pentru părinți, cum ar fi Foundation for Angelman Syndrome Therapeutics și Angelman Syndrome Foundation. Subiecții sunt înscriși cu următoarele criterii de includere: diagnostic confirmat genetic al sindromului Angelman; vârsta 4-11 ani; în prezent pe un LGIT, KD (convențional 4: 1 sau 3: 1, MCT, Atkins modificat) sau dietă standard (dietă obișnuită) în mod constant timp de cel puțin 3 luni; disponibilitatea de a consuma formularea de investigație; și disponibilitatea de a face examinări de protocol la domiciliu și vizite la clinică. Subiecții sunt excluși dacă: necesită nutriție parenterală; aveți disfuncție hepatică sau renală majoră; aveți antecedente de diabet sau aveți diabet zaharat; sunt semnificativ subponderali cu un indice de masă corporală Fig. 1
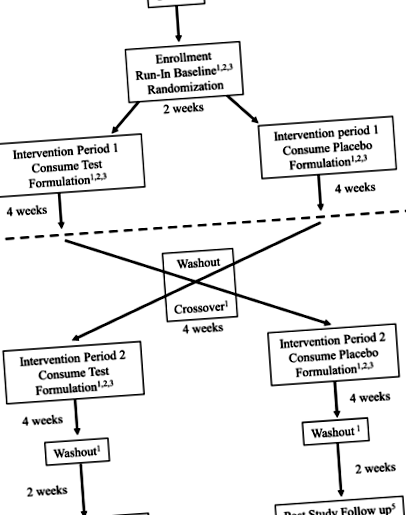
Proiectarea studiului FANS - studiu randomizat, controlat cu placebo, crossover. Elementele protocolului standard: recomandări pentru încercări intervenționale (SPIRIT) Figura; programul de înscriere, intervenții și evaluări. * Poate fi efectuat telefonic sau personal la sediul clinicii. ** O probă suplimentară de sânge va fi colectată în timpul vizitei inițiale și adăugată la un depozit. Probele pot fi utilizate pentru studii precum ADN și ARN, proteomică și metabolomică și pot fi utilizate pentru studii auxiliare fără legătură cu studiul actual. În momentul publicării, nu au fost planificate alte studii
Proiectarea studiului pentru acest protocol de intervenție nutrițională este un studiu încrucișat, dublu-orb, controlat cu placebo. Studiul are două direcții: (1) o perioadă de formulare investigativă urmată de o perioadă de formulare placebo sau (2) o perioadă de formulare placebo urmată de o perioadă de formulare investigativă. Fiecare pacient va primi atât formularea de investigație, cât și formularea placebo, cu o perioadă de spălare între fiecare braț. Programul de randomizare a fost creat de Investigational Drug Service Pharmacy folosind software-ul de randomizare într-un raport 1: 1 cu o dimensiune de bloc de 4. Participanții au fost înscriși în următorul slot deschis de pe masa de randomizare. Formulările nutriționale sunt codificate de numărul lotului producătorului și, prin urmare, personalul clinic este orb de conținutul real al recipientului (versete active placebo).
Odată randomizați, subiecții încep Perioada de intervenție 1, o perioadă de 4 săptămâni în care primesc formulări nutriționale care conțin BHB sau placebo, menținând în același timp dieta menționată la intrarea în studiu. Monitorizarea la domiciliu are loc așa cum este indicat în Fig. 1. După 4 săptămâni de intervenție orbită, subiecții sunt evaluați în clinică și apoi încetează consumul de formulare cetonică sau placebo pentru o perioadă de spălare de 4 săptămâni. După finalizarea spălării, subiecții intră într-o a doua perioadă de 4 săptămâni în care primesc formulare versus placebo. Vor continua monitorizarea la domiciliu pe toată durata studiului. Ulterior, la finalizarea celei de-a doua intervenții, aceștia sunt supuși vizitei finale de studiu programate și prelevării de probe de laborator. O perioadă de spălare urmează perioadei de intervenție 2, iar la aproximativ săptămâna 16 a studiului, se face un apel de urmărire către familie pentru a revizui simptomele și a se asigura că pacientul nu se confruntă cu evenimente adverse în această perioadă. Programul de încercare pentru înscriere, intervenții și evaluări este prezentat în Fig. 1 (Programul de încercare FANS al procedurilor).
Proceduri și intervenții
Tolerabilitatea este determinată la sfârșitul fiecărei perioade de intervenție de 4 săptămâni. Conformitatea protocolului este monitorizată atât în perioadele de intervenție investigaționale, cât și în perioadele de intervenție placebo prin înregistrarea cantității de formulare consumată. Acceptabilitatea formulării este evaluată la sfârșitul fiecărei perioade de intervenție printr-un chestionar părinte care evaluează comoditatea, gustul și gradul de acceptare a formulării nutriționale pe o scală Likert de 10 puncte sau pe baza respectării protocolului de studiu și a consumului formulării de trei ori zilnic consecvent în timpul perioadei de intervenție de 4 săptămâni. Sisteme similare de clasificare pentru a evalua acceptabilitatea formulării au fost utilizate cu alte intervenții nutriționale în populațiile de epilepsie [22,23,24,25].
Siguranța este evaluată pe întreaga perioadă a protocolului prin (1) raportarea evenimentelor adverse și (2) evaluarea parametrilor clinici colectați pe parcursul protocolului, inclusiv antropometrie, profilul metabolismului sanguin, aportul alimentar, frecvența convulsiilor, EEG, ERP, mobilitate, funcția GI și obiceiuri de somn. La această populație, potențialul efectelor negative ale intervenției trebuie monitorizat îndeaproape, deoarece pacienții sunt nonverbali. Fișierul suplimentar 4 conține detalii despre colectarea, evaluarea, raportarea și gestionarea evenimentelor adverse solicitate și raportate spontan.
Formulările de investigație și placebo sunt administrate cu mărimea porției pe baza greutății corporale a subiectului. Formularea de investigație furnizează beta-hidroxibutirat, 2 g carbohidrați, 1 g proteine și 9 g grăsimi, plus minerale, la 100 kcal. Placebo este potrivit doar pentru conținutul de minerale. Formula se administrează oral ca alimente sau băuturi de trei ori pe zi.
Considerații statistice
Rezultatul principal al studiului este de a evalua tolerabilitatea unei formulări nutriționale care conține BHB la pacienții cu SA. Tolerabilitatea este demonstrată prin respectarea de către pacient a protocolului, determinată de cantitatea de formulare consumată în comparație cu cantitatea prescrisă și este evaluată la sfârșitul fiecărei perioade de intervenție. Întreruperea prematură a formulării nutriționale de către familie este, de asemenea, considerată ca potențială intolerabilitate. Tolerabilitatea este, de asemenea, evaluată la sfârșitul fiecărei perioade de intervenție printr-un chestionar parental. Aceste măsuri de rezultat au fost alese deoarece aceasta este o populație vulnerabilă, nonverbală, cu capacitate limitată de comunicare și, prin urmare, determinarea dacă formularea este adecvată și bine tolerată este un prim pas adecvat.
Rezultatele secundare includ evaluarea cetozei atunci când se consumă formularea nutrițională și siguranța formulării nutriționale la pacienții cu SA. Cetoza este evaluată zilnic prin testarea urinei, precum și prin analiza sângelui la sfârșitul fiecărei perioade de intervenție. Gradul și momentul cetozei pot fi relevante din punct de vedere clinic pentru a demonstra o nutriție mai bună a pacientului, deoarece cetoza nutrițională a fost legată de rezultate mai bune ale pacienților, așa cum este descris în fundalul acestui manuscris. Siguranța este evaluată prin modificări ale funcției motorii, funcției cognitive, toleranței GI, somnului și convulsiilor, împreună cu modificările înălțimii, greutății și panourilor metabolice din sânge, evaluate la sfârșitul fiecărei perioade de intervenție. În plus, raportarea evenimentelor adverse este monitorizată în timp real de către coordonatorul studiului.
Nu există studii care să testeze suplimentarea cetonică la pacienții cu SA. Prin urmare, estimarea mărimii eșantionului se bazează pe măsurători ale cetozei. Se presupune din investigațiile preclinice murine, din studiile clinice non-AS care utilizează MCT și/sau BHB și intervențiile dietetice cu conținut scăzut de carbohidrați, că modificarea minimă a rezultatului secundar, gradul de cetoză, de la momentul inițial până la sfârșitul a patra săptămână a perioadei de intervenție a formulării investigaționale va fi o schimbare de 100% față de valoarea inițială (valoarea inițială pentru dieta standard este de obicei
Discuţie
Sindromul Angelman se caracterizează prin epilepsie refractară. De fapt, EEG-urile persoanelor cu SA sunt anormale în comparație cu controalele neurotipice, chiar și în absența convulsiilor [26]. Postul a fost recunoscut ca un tratament potențial pentru convulsii din cele mai vechi timpuri, iar intervenția dietetică care imita postul a fost introdusă la începutul anilor 1920 [27, 28]. Aceste diete plasează corpul într-o stare de cetoză metabolică nutrițională. Folosind cetoza nutrițională ca model, multe intervenții dietetice au fost studiate atât în modele animale, cât și în studii clinice la om pentru o varietate de tulburări neurologice.
Pentru copiii cu epilepsie refractară, intervențiile dietetice care duc la cetoza nutrițională sunt eficiente și sigure. O dietă Atkin modificată, studiată prospectiv la copii cu vârsta cuprinsă între 3 și 18 ani, a demonstrat că cetoza urinară moderată s-a dezvoltat în decurs de 4 zile, cu o îmbunătățire semnificativă a frecvenței convulsiilor la 6 luni [29]. În AS, rapoartele de caz demonstrează, de asemenea, eficacitatea [30]. Pentru o fetiță de 5 ani cu crize zilnice incontrolabile, rezistente la terapia triple-anticonvulsivantă, o KD s-a dovedit a fi eficientă în diminuarea convulsiilor încă din prima săptămână de inițiere. Un EEG fără activitate epileptică a confirmat îmbunătățirea pacientului împreună cu îmbunătățirea somnului și a hiperactivității. Într-un studiu separat la pacienți cu SA, 4 luni de LGIT au dus la scăderea frecvenței convulsiilor cu îmbunătățirea corelativă a EEG post-proces, cu dovezi ale progresului dezvoltării. Dieta a fost bine tolerată și cinci din șase subiecți au rămas pe LGIT după finalizarea studiului [14]. O revizuire retrospectivă a dosarului medical a 23 de subiecți cu SA care au utilizat LGIT a sugerat că 22% dintre subiecți au menținut libertatea completă a convulsiilor, 43% au menținut libertatea convulsivă, cu excepția cazului în care se află boala sau starea epileptică neconvulsivă și 30% au avut o scădere a convulsiei frecvență [13].
Literatura sugerează o tranziție sigură de la glucoză la corpurile cetonice ca combustibil. Un studiu amplu privind utilizarea dietei LGIT în epilepsia pediatrică a relevat efecte secundare limitate și o frecvență scăzută a convulsiilor [31]. Studiile asupra dietei MCT au relevat reclamațiile GI ca fiind cea mai mare problemă de tolerabilitate [32]. De asemenea, a fost raportată acidoză. Riscul de deficiență nutrițională la copii la tratamentele dietetice restrictive și lipsa suplimentelor specifice KD au ridicat îngrijorări cu privire la starea micronutrienților. Nivelurile de vitamine A și E, zinc, seleniu, calciu și magneziu au fost măsurate la copiii cu epilepsie intratabilă, tratați cu KD [33]. Cercetătorii au sugerat că modificările vitaminelor A și E din plasmă și scăderea stării de magneziu după 12 luni pot fi suboptimale și necesită abordări suplimentare la KD.
Dovezile la animale care susțin suplimentarea cetonică și dovezile clinice pentru KD în modelele AS și, respectiv, controlul convulsiilor, sugerează că intervențiile dietetice, inclusiv cetone exogene, pot fi o dezvoltare importantă în strategiile de management clinic. Studiul actual este conceput ca o evaluare inițială a formulărilor ketogenice utilizate cu o varietate de medii dietetice. Reprezintă o oportunitate unică de a studia beneficiile potențiale ale intervenției nutriționale la o populație pediatrică (cu vârste cuprinse între 4 și 11 ani) cu SA. Cunoștințele acumulate în urma studiului pot ghida evaluări ulterioare în utilizarea cetonelor exogene pentru strategiile nutriționale în managementul dietetic al pacienților AS.
La populația AS se știe că există un efect placebo mare. Studiul nostru oferă, de asemenea, un design unic în care este prioritizată utilizarea măsurilor obiective. Sperăm că acest lucru va produce măsuri care vor aduce beneficii studiilor viitoare în comunitatea Angelman, pe lângă o înțelegere mai clară a eficacității generale și a mecanismului de acțiune al BHB pentru inducerea cetozei. Scopul final va fi de a avea un impact pozitiv asupra stării nutriționale, care ar trebui să sporească capacitatea pacientului de a depăși simptomele AS, cum ar fi convulsiile, cunoașterea și învățarea, mersul/mobilitatea și/sau tulburările de somn.
Starea procesului
ClinicalTrials.gov, ID: NCT03644693. Înregistrat la 23 august 2018. Ultima actualizare la 23 august 2018; data de începere a recrutării noiembrie 2018; data aproximativă de finalizare decembrie 2019.
Disponibilitatea datelor și a materialelor
Partajarea datelor nu se aplică acestui articol, deoarece nu au fost generate sau analizate seturi de date în timpul studiului actual. Investigatorul principal și echipa clinică vor avea acces la setul de date final. Echipa de cercetare de la Disruptive Nutrition va avea acces doar la date dezidentificate.
- Formularea și evaluarea nutrițională a alimentelor înțărcate procesate din gătitul bananei, suplimentate
- Proiectarea și validarea unui chestionar privind frecvența alimentelor (FFQ) pentru evaluarea nutrițională a
- Evaluarea compoziției nutriționale a nuferului (Nymphaea lotus Linn
- Evaluarea unui chestionar pentru a evalua cunoștințele nutriționale, atitudinile și practicile într-un thailandez
- Convertiți BTU în unitate termică Cal British în alimente nutriționale calorii