Termeni asociați:
- Fibroblast
- Bilă
- Nefron
- Encefalopatie
- Bucla lui Henle
- Functie renala
- Hipokaliemie
- Miopatie
- Hiperaldosteronism
- Reabsorbție
Descărcați în format PDF
Despre această pagină
Tulburări ereditare ale tubului proximal
Fiziopatologie celulară
În cele din urmă, celulele cistinotice pot avea o sensibilitate crescută la leziunile oxidative. În special, pacienții cu cistinoză nefropatică excretă cantități mai mari decât de obicei de acid piroglutamic (5-oxoprolină), sugerând epuizarea glutationului, un antioxidant intracelular major. 79 Acidul piroglutamic și cisteina sunt principalii metaboliți ai ciclului γ-glutamil dependent de ATP, care este mai sensibil la depleția ATP și la alți factori de stres din celulele cistinotice. 80 Reducerea modestă a glutationului celular a fost raportată în unele studii, dar nu în toate, asupra celulelor cistinotice. 81, 82 Cu toate acestea, au fost raportate creșteri ale raportului dintre glutation disulfură oxidată (GSSG) și glutation, 81 pe lângă creșterea activității superoxidului dismutază 82; ambele observații sunt în concordanță cu stresul oxidativ crescut în celulele cistinotice.
Sindromul Fanconi
Orson W. Moe,. Michel Baum, în Boli genetice ale rinichiului, 2009
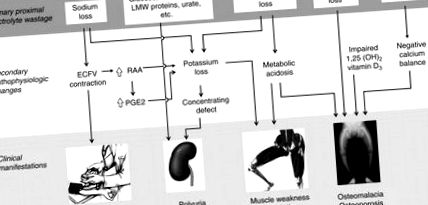
Relația deșeurilor solide cu caracteristicile clinice esențiale
Figura 10.4. Relația dintre tulburarea primară, modificările fiziopatologice secundare și manifestările clinice majore ale sindromului Fanconi. Deșeurile grupurilor majore de substanțe dizolvate sunt prezentate pe panoul superior (casete). Modificările lor fiziopatologice secundare sunt prezentate în panoul din mijloc. Modul în care aceste modificări duc la patru dintre caracteristicile clinice cardinale ale sindromului este descris în panoul inferior. Nu sunt prezentate toate defectele fiziopatologice și clinice. Abrevieri: LMW = Greutate moleculară mică, ECFV = Volumul de lichid extracelular, RAA = Sistemul renin angiotensinei aldosteron, PGE2 = Prostaglandina E2
Principalele consecințe clinice provin din risipa de substanțe dizolvate anorganice (Figura 10.4). Excreția renală de NaCl are ca rezultat contracția volumului, o reducere a ratei de filtrare glomerulară și încărcarea filtrată a Na. Pacienții cu sindrom Fanconi sunt în echilibru Na + cu prețul contracției cronice a volumului. Contracția cronică a volumului predispune pacienții cu sindrom Fanconi la hipotensiune severă și care poate pune viața în pericol atunci când sunt stresați, cu vărsături sau diaree. Alte simptome secundare includ pofta de sare și constipație.
Deși hipofosfatemia se poate manifesta acut cu rabdomioliză (Knochel 1993), această complicație nu a fost raportată până în prezent în sindromul Fanconi. Prezentarea mai frecventă este o miopatie cronică datorată în principal fosfatului și într-o oarecare măsură epuizării potasiului. Miopatia cauzată de epuizarea fosfatului se observă în sindromul Fanconi, dar poate rezulta și din diverse cauze de irosire a fosfatului renal sau de malabsorbție intestinală (Insogna și colab. 1980; Lian și colab. 1994; Rago și colab. 1994; Campos și colab. 1995; Wang și colab. 2000a, Parsonage et al 2005). Pierderea fosfatului renal a fost descoperită ca o cauză a sindromului de oboseală cronică nespecifică (De Lorenzo și colab. 1998). Depleția fosfatului este asociată cu disfuncție neuromusculară datorată modificărilor respirației mitocondriale și defectelor metabolismului oxidativ intracelular.
Complicațiile diabetului zaharat
Acidoza tubulară renală
O anomalie funcțională binecunoscută asociată cu tubulopatia diabetică este acidoza tubulară renală, care se manifestă ca hiperkaliemie și acidoză metabolică hipercloremică. 542 Se crede că aceasta este o manifestare a hipoaldosteronismului hiporeninemic asociat cu diabetul, rezultând o producție proximală de amoniac tubular redusă la niveluri inadecvate pentru tamponarea acidului în nefronul distal. Cauzele precise ale acestei anomalii rămân de stabilit. La unii pacienți pare să existe un defect în conversia proreninei în renină activă. 543 S-a sugerat, de asemenea, că deteriorarea celulelor tubulare ale aparatului juxtaglomerular asociate cu diabetul poate contribui la eliberarea reninei afectată, posibil din cauza producției reduse de prostaglandine renale și a nivelurilor crescute de vasopresină. 544
Un risc major asociat cu hipoaldosteronismul hiporeninemic este dezvoltarea hiperkaliemiei care pune viața în pericol. Aceasta este o problemă din ce în ce mai importantă cu utilizarea pe scară largă a inhibitorilor ECA și a ARB-urilor, adesea în combinație, la această populație. Acest lucru este în continuare agravat de utilizarea diureticelor care economisesc potasiul (cum ar fi spironolactona) și a beta-blocantelor.
Un sondaj anual la nivel mondial al noilor date privind reacțiile adverse la medicamente
Marta Martín Millán, Santos Castañeda, în Efectele secundare ale drogurilor Anual, 2015
Tractului urinar
Nefroza colemică reprezintă un spectru de leziuni renale de la tubulopatia proximală până la formarea de bilă intrarenală găsită la pacienții cu disfuncție hepatică severă. Cel mai adesea, pacienții cu icter obstructiv sever dezvoltă această leziune, despre care se crede că apare din cauza leziunilor directe ale acidului biliar al celulelor tubulare, precum și a obstrucției turnărilor de acid biliar. În aceste condiții, leziunea tubulară acută se dezvoltă dintr-o combinație de modificări hemodinamice, cu o contribuție de la toxicitatea tubulară directă legată de acidul biliar și de turnările biliare obstructive. Autorii au prezentat cazul leziunilor renale acute datorate nefropatiei biliare la un culturist care a dezvoltat o boală hepatică colestatică severă în cadrul utilizării steroizilor anabolici androgenici [39 A].
Abordări terapeutice ale bolilor canalului ionic
Diana Conte Camerino,. Antonella Liantonio, în Progrese în genetică, 2008
2 sindroamele lui Bartter
Sindromul Bartter (BS) este un grup de tubulopatii ereditare strâns legate, dintre care două se datorează mutațiilor genelor care codifică canalele ionice precum ROMK (tip II) și CLC-Kb (tip III) (Hebert, 2003). În plus, întreruperea genei care codifică barttin, subunitatea β esențială pentru expresia și funcționalitatea canalelor CLC-K, duce la BS de tip IV (Birkenhäger și colab., 2001). Fenotipurile asociate diferitelor tipuri de BS sunt extrem de variabile și se pot prezenta fie ca o variantă prenatală tipică cu sau fără surditate, fie ca sindrom Bartter clasic caracterizat printr-un debut în copilărie sau în copilăria timpurie (Konrad și colab., 2000; Naesens și colab. ., 2004). Pe lângă risipa marcată de sare, pacienții prezintă polidipsie, poliurie în urma hipokaliemiei, contracției volumului, slăbiciunii musculare și întârzierii creșterii. Simptomele primare ale BS duc la o creștere secundară a prostaglandinelor ca o consecință a contracției volumului, iar multe probleme clinice sunt legate de prostaglandinele crescute (Hebert, 2003).
Terapia BS rămâne empirică (Kleta și Bockenhauer, 2006). În practică, terapiile medicamentoase și de substituție (K +, Mg 2 + și uneori Na +) sunt în esență ghidate de ameliorarea simptomelor. AINS, cum ar fi indometacina, inhibitorii enzimei de conversie a angiotensinei și antagoniștii aldosteronului, au fost folosiți în mod obișnuit cu diferite grade de succes și tolerabilitate. Cu toate acestea, utilizarea acestor medicamente pentru tratarea acestor sindroame nu este o indicație aprobată. Într-adevăr, un factor limitativ în tratamentul disponibil actual este riscul indus de medicamente de afectare renală progresivă, care poate duce în cele din urmă la insuficiență renală cronică (Unwin și Capasso, 2006).
În ultimii ani, inhibarea farmacologică și activarea CLC-Ka/barttin și a CLC-Kb/barttin au fost studiate în detaliu considerabil, deschizând calea spre identificarea medicamentelor potențial utile pentru sindromul Bartter sau ca diuretice (vezi Fig. 4.4 și secțiunea III).
Figura 4.4. Canalele ionice implicate în canalopatiile mușchilor scheletici și ținta medicamentelor. Sunt raportate canale și gene conexe, clase de medicamente cu exemple și indicații terapeutice.
Modificat din Ashcroft (2006) .
Mutațiile BCS1L ca cauză a sindromului Björnstad - Sindrom GRACILE Deficitul complexului III
Perle clinice
Sindromul Björnstad, care cauzează pierderea auzului senzorial neural congenital, sindromul GRACILE și fenotipul complexului infantil III tubulopatie-hepatopatie-encefalopatie sindrom poate fi cauzat de mutații în BCS1L.
Deoarece pili corti și surditatea congenitală sunt ușor identificate, considerarea bolii asociate BCS1L ar trebui luată în considerare atât în sindromul clasic Björnstad, cât și în sindromul Björnstad, cu caracteristici suplimentare, inclusiv encefalopatia, dizabilitățile de dezvoltare, eșecul de a prospera și caracteristicile disfuncției organelor multiple.
Deși constatările biopsiei musculare în cazul 1 au demonstrat dovezi neechivoce ale disfuncției complexului III, ar trebui subliniat faptul că acest caz prezentat înainte de stabilirea legăturii dintre fenotip și genotip și înainte de testarea comercială pentru această genă. Prin urmare, se sugerează că, dacă boala este de-a lungul spectrului bolii asociate BCS1L, secvențierea genelor este mai puțin invazivă și mai puțin costisitoare decât o biopsie musculară.
Mecanisme farmacogenomice de toxicitate a medicamentelor
Transportori și tenofovir Toxicitate renală
FIGURI 17.6. Proteine transportoare implicate în eliminarea TFV prin celule tubulare proximale. Secreția de tenofovir de către celulele tubulare proximale: 20-30% din tenofovir este excretat nemodificat în urină prin secreția activă de către celulele tubulare proximale. OAT1 este principalul transportor care ia tenofovir în celula tubulară proximală, deși contribuie și OAT3. Odată ajuns în celulele tubulare proximale, tenofovirul trebuie extrudat în lumenul tubular de MRP2 și MRP4. Recent, MRP10 a fost implicat și în transportul TFV (nu este prezentat în figură). Celulele tubulare proximale sunt sensibile în mod unic la toxicitatea tenofovirului deoarece exprimă transportorii care cresc concentrațiile intracelulare ale medicamentului și sunt bogate în mitocondrii [58]. MRP, proteină multirezistentă; OAT, proteină transportoare de anioni organici; TFV, tenofovir.
Datorită variabilității interindividuale ridicate în prezentarea anomaliilor funcției renale, cercetătorii s-au concentrat recent asupra factorilor genetici ai gazdei care predispun la disfuncția renală asociată TFV [61]. Proteinele transportoare implicate în eliminarea renală a TFV, cum ar fi transportorii de anioni organici (OAT) sau MRP 2, 4 sau 10, au fost în centrul acestor studii (Figura 17.6). În special, mai mulți polimorfisme genetice la acești transportori au fost asociați cu un risc crescut de tubulopatie renală la pacienții tratați cu TDF [49, 61-63]. Factorii farmacogenetici relevanți care pot juca un rol în riscul de toxicitate renală asociat cu utilizarea tenofovirului sunt rezumați în Tabelul 17.2. .
TABELUL 17.2. Polimorfisme în transportoare și asocierea lor cu leziuni renale
| ABCC2 (MRP2) | rs717620 | −24C> T | 5′-UTR | Nicio influență clară asupra legării ADN-proteine și stabilitatea ARNm nu au diferit semnificativ. În celulele HEK293T/17 transfectate; expresie proteică semnificativ mai scăzută [125] | Purtătorii alelei -24 T au eliminat cu 19% mai mult TFV decât purtătorii alelei comune; Genotipul CC este mai frecvent la pacienții cu leziuni tubulare [60, 62] |
| ABCC2 (MRP2) | rs7080681 | 1058G> A | Arg353His | N/A. | Nicio asociere cu afectarea renală |
| ABCC2 (MRP2) | rs2273697 | 1249G> A | Val417Ile | Vmax ↓; Km ↓ (pentru anumite substraturi din celula sf9 [126]; creșterea semnificativă a expresiei proteinelor (celula HEK293T/17) [125] | Genotipul AA este mai frecvent la pacienții cu leziuni tubulare proximale; nicio asociere cu afectarea renală [60, 61] |
| rs8187694 | 3563T> A | Val1188Glu | N/A. | Genotipul TT este mai frecvent la pacienții cu leziuni tubulare proximale; nicio asociere cu afectarea renală [60, 61] | |
| rs3740066 | 3972C> T | Ile1324Ile | Creșterea semnificativă a expresiei proteinelor (celula HEK293T/17) [125] | Nicio asociere cu afectarea renală [60, 61] | |
| rs8187710 | 4544G> A | Cys1515Tyr | N/A. | O alelă nu este prezentă la pacienții cu leziuni tubulare proximale; nicio asociere cu afectarea renală [60, 61] | |
| ABCC2 (MRP2) | - | Haplotip CATC | - | Creșterea semnificativă a expresiei proteinelor (celula HEK293T/17) [125] | Risc de leziuni tubulare proximale [61] |
| ABCC4 (MRP4) | rs11568685 | 559G> T | Gly187Trp | Funcție redusă și expresie scăzută (HEK 293T) [42] | Nicio asociere cu afectarea renală [61] |
| rs899494 | 669C> T | Ile223Ile | N/A. | Alela T este mai frecventă la pacienții cu leziuni tubulare proximale; nicio asociere cu afectarea renală [60, 61] | |
| rs2274407 | 912G> T | Lys304Asn | Fără alternanță funcțională (HEK 293T) [42] | Nicio asociere cu afectarea renală [61] | |
| rs2274406) | 951G> A | Arg317Arg | N/A. | ||
| rs2274405) | 969G> A | Ser323Ser | N/A. | ||
| rs1557070 | 1497C> T | Tyr499Tyr | N/A. | ||
| rs11568655 | 3310T> C | Leu1104Leu | N/A. | ||
| rs1751034 | 3348A> G | Lys1116Lys | N/A. | ||
| rs11568695 | 3609G> A | Ala1203Ala | N/A. | ||
| ABCC4 (MRP4) | rs3742106 | 4135T> G | 3'UTR | N/A. | Nicio asociere cu eliminarea TFV și nicio asociere cu leziuni renale [60, 62] |
| ABCC10 (MRP7) | rs9349256 | 2137G> A | Intron | N/A. | Asociat semnificativ cu disfuncția tubulară renală (KTD); irosirea fosforului în urină și microglobulinuria β2 [63] |
| ABCC10 (MRP7) | rs2125739 | 2843T> C | Ile948Thr | N/A. | |
| ABCC10 (MRP7) | - | HaplotypeGGC | - | N/A. | |
| ABCC10 (MRP7) - ABCC1 (MRP2) | - | HaplotypeGGC-CGTC | - | N/A. | În mod semnificativ mai mare în grupul KTD decât în controale [63] |
| ABCB1 (P-gp) | rs1128503 | 1236 C> T | Gly412Gly | N/A. | Nicio asociere cu afectarea renală [60, 61] |
| rs2032582 | 2677 G> A/T | Ala893Ser/Thr | Eflux sporit de digoxină [127] | ||
| rs1045642 | 3435 C> T | Ile1145Ile | N/A. | ||
| SLC22A6 (OAT1) | rs11568634 | 1361 G> A | Arg454Gln | Non-funcțional în ceea ce privește adenovirul testat în ovocitele X. laevis [128] | Nici o diferență în clearance-ul renal și clearance-ul secretor al adefovirului în studiile familiale [60, 62] |
| SLC22A11 (OAT4) | rs11231809 | g.64302950 T> A | - | N/A. | Nicio asociere cu afectarea renală [60] |
N.A., nu este disponibil.
În timp ce rolul MRP2 în excreția renală TFV este discutabil, MRP4, codificat de gena ABCC4, pare să joace un rol important în secreția tubulară TFV. Într-un studiu, polimorfismul ABCC4 669C> T a fost găsit la o proporție mai mare de indivizi tratați cu TFV care au dezvoltat leziuni tubulare renale [61]. Cu toate acestea, această constatare nu a fost confirmată de alții [60]. De atunci, au fost examinați și alți SNP, inclusiv ABCC4 559G> T, 912G> T, 951G> A, 969G> A, 1497C> T, 3310T> C și 3348A> G. Niciunul dintre ei nu sa dovedit a fi asociat cu un risc mai mare de afectare a rinichilor asociate TFV [60, 61]. Deși alela ABCC4 4131T> G a fost asociată anterior cu niveluri intracelulare mai ridicate de lamivudină la pacienții care dețin genotipul 4131GG (concentrații cu 20% mai mari de lamivudină-trifosfat decât purtătorii alelei comune), acest polimorfism nu a arătat nicio asociere cu nivelurile intracelulare TFV [65]. Colectiv, rolul variantelor genetice MRP4 în modularea toxicității rinichiului TFV nu a fost confirmat.
Polimorfismele din ABCB1 și OAT1, care este principalul transportor care ia tenofovir în celula tubulară proximală, deși contribuie și OAT3, au fost, de asemenea, asociate cu toxicitate renală datorată TFV; cu toate acestea, rezultatele generale sugerează că polimorfismele din aceste două gene nu au niciun efect asupra disfuncției renale asociate TFV [60, 61]. În plus față de factorii genetici, factori non-genetici, cum ar fi vârsta, greutatea corporală și sexul, au fost într-o anumită măsură legați de incidența disfuncției renale la pacienții tratați cu TFV. De exemplu, s-a raportat că toxicitatea renală apare mai frecvent la bărbați decât la femei [62, 67]. Alte variabile care pot crește riscul de toxicitate renală din TFV includ insuficiența renală preexistentă și utilizarea concomitentă a medicamentelor nefrotoxice didanozină (DDI) sau inhibitori de protează și, în special, ritonavir [68]. .
Gammopatiile monoclonale: leziuni glomerulare și tubulare
Tubulopatie proximală cu lanț ușor
Din punct de vedere clinic, afectarea tubulară proximală este de obicei subtilă cu un sindrom Fanconi dobândit parțial sau complet (FS) (aminoacidurie, fosfaturie și glucozurie); pot exista, de asemenea, proteinurie subnefrotică, uricosurie și, uneori, acidoză tubulară renală tip II (de origine tubulară proximală). În timp ce disfuncția renală poate fi inițial subtilă, în timp, se dezvoltă insuficiența renală.
Alți termeni asociați cu această afecțiune includ FS pentru adulți, FS cu lanț ușor, cristalopatii și/sau LCPT.
Prin microscopie cu lumină, cristalele intracelulare pot fi văzute focal, dar, în absența lor, diagnosticul diferențial principal este necroza tubulară acută din alte cauze ( Figura 6 ). Un diagnostic de LCPT este susținut de demonstrarea restricției lanțului ușor în tubulii proximali. În timp ce, în multe cazuri, lanțul ușor intracitoplasmatic poate fi detectat prin imunohistochimie, într-un subgrup de cazuri, anticorpii anti-lanț ușor pot să nu fie reactivi. Acest lucru se poate datora unor anomalii intrinseci în lanțurile ușoare sau a digestiei lor parțiale; sechestrarea lanțului ușor în organitele celulare le poate face, de asemenea, nereactive și poate fi necesară digestia enzimatică. De obicei, LCPT cristalină este asociată cu lanțuri ușoare κ, în timp ce forma necristalină este asociată cu lanțuri ușoare λ. Prin microscopie electronică, lanțurile ușoare cristaline pot fi văzute ca structuri în formă de ac, rotunde sau dreptunghiulare până la tije, cu densitate de electroni, în citoplasma celulelor tubulare proximale.
- Dieta vegetariană - o prezentare generală Subiecte ScienceDirect
- Uterus Synechia - o prezentare generală Subiecte ScienceDirect
- Total Stomach Resection - o prezentare generală Subiecte ScienceDirect
- Ureaplasma urealyticum - o prezentare generală a subiectelor ScienceDirect
- Impactul obezității asupra bunăstării psihologice - ScienceDirect