Abstract
fundal
Hiperhomocisteinemia a fost suspectată de favorizarea trombozei. Mai multe studii de caz-control și chiar o meta-analiză au confirmat o legătură între tromboza venoasă și hiperhomocisteinemie. Homocisteina se datorează factorilor genetici și dobândiți (dietă slabă în folat și vitamina B12, vârstă mai înaintată, insuficiență renală, boli tiroidiene și tumori maligne) induse de aportul și concentrațiile de vitamina B9 sau B12 în majoritatea cazurilor.
Prezentarea cazurilor
Raportăm cazurile a patru pacienți marocani care au prezentat tromboză venoasă acută în diferite locuri: un bărbat de 34 de ani, un bărbat de 60 de ani, un bărbat de 58 de ani și o femeie de 47 de ani . Toți pacienții au avut un nivel scăzut de cobalamină cu hiperhomocisteinemie marcată cu ser normal și acid folic celular. Tromboza venoasă a relevat anemie periculoasă la toți pacienții. Nivelurile lor scăzute de cobalamină, gastrita atrofică și rezultatele pozitive pentru anticorpii gastrici cu celule parietale au confirmat diagnosticul de anemie pernicioasă. Nu au existat dovezi de imobilizare, intervenții chirurgicale recente, malignitate, anticorp antifosfolipidic, tulburare mieloproliferativă sau terapie de substituție hormonală. Nu au fost detectate deficiențe în proteina C și proteina S; aveau funcția normală antitrombină III și factorul V Leiden; nu au fost detectate mutații ale genei protrombinei. Tratamentul a inclus terapie anticoagulantă administrată oral și suplimentarea cu cobalamină. Rezultatul a fost favorabil în toate cazurile.
Concluzii
Aceste rapoarte demonstrează că anemia pernicioasă, singură, poate duce la hiperhomocisteinemie suficient de semnificativă pentru a duce la tromboză. Înțelegerea patogeniei moleculare a dezvoltării trombozei la pacienții cu hiperhomocisteinemie legată de boala Biermer ne-ar ajuta să identificăm pacienții cu risc și să îi tratăm în consecință. Literatura referitoare la relația dintre homocisteină și tromboza venoasă este revizuită pe scurt.
fundal
Homocisteina este un aminoacid format din demetilarea intracelulară a metioninei. Hiperhomocisteinemia se caracterizează printr-o creștere a nivelului seric de homocisteină. Se crede că este un factor de risc modificabil al infarctului miocardic, al trombozei arteriale periferice, precum și al trombozei venoase profunde și al emboliei pulmonare [1,2,3]. Majoritatea rapoartelor legate de boala arterială descriu o asociere cu un nivel ușor crescut de homocisteină. În schimb, există publicații limitate și conflictuale legate de tromboza sistemului venos asociată cu nivelul homocisteinei [4,5,6,7,8].
Hiperhomocisteinemia poate rezulta din defecte genetice ale enzimelor implicate în metabolismul homocisteinei: cistationina ß-sintaza (CBS), metionina sintaza (MS) și N5, N10-metilenetetrahidrofolat reductaza (MTHFR) sau din deficiențele cofactorilor enzimelor (vitamina B6, vitamina B6 sau cosubstrat vitamina B9) [5].
Cu toate acestea, cea mai frecventă cauză a deficitului de vitamina B12 cu hiperhomocisteinemie este anemia pernicioasă. Anemia pernicioasă este de obicei diagnosticată în prezența anemiei megaloblastice, a simptomelor neurologice sau a gastritei atrofice. Evenimentele trombotice au fost raportate a fi un simptom revelator [9,10,11,12,13,14,15,16]. Am raportat patru cazuri de tromboză venoasă care relevă anemie pernicioasă.
Prezentarea cazului
Cazul 1
Cazul 2
Un bărbat marocan în vârstă de 60 de ani, sănătos, fără antecedente medicale, a prezentat la spitalul nostru anemie și tromboză venoasă profundă la piciorul drept. Un examen fizic a arătat paloare și umflarea piciorului drept cu semne de flebită. Ultrasonografia a relevat tromboflebită în venele sale ileofemorale și poplitee drepte. Nivelul său de hemoglobină a fost de 9,5 g/dl, iar volumul corpuscular mediu a fost de 111 μm 3. Nivelul său de homocisteină plasmatică a fost de 125 μmol/l (normal 120). Nivelul său plasmatic de folat a fost în limitele normale. Aspirația măduvei osoase cu biopsie a arătat megaloblastoză. Anticorpii împotriva factorului intrinsec au fost pozitivi; o endoscopie a relevat gastrită atrofică. Nicio altă anomalie nu a fost găsită într-un ecran mai detaliat pentru neoplasm sau boala Behçet. Anticorpul antinuclear a fost negativ.
Tratamentul său a inclus terapie anticoagulantă administrată intravenos cu heparină, care a fost administrată ulterior pe cale orală. Vitamina B12 a fost administrată în doză mare intravenos. În ziua 7, hemoglobina sa era de 11 g/dl.
După o perioadă de urmărire de 6 luni, sub tratament cu cobalamină și anticoagulant administrat oral, nivelurile plasmatice ale hemoglobinei și ale homocisteinei sale au fost în intervalul normal. A rămas liber de evenimente trombotice timp de 3 ani după urmărire.
Cazul 3
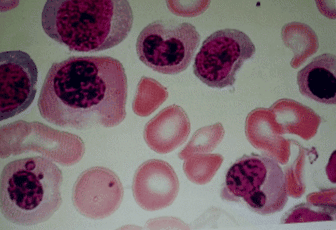
Un bărbat marocan de 58 de ani a prezentat la spitalul nostru anemie și umflarea piciorului drept. Nu avea antecedente medicale și un examen fizic a arătat paloare și semne de flebită la piciorul drept. Ultrasonografia a relevat o tromboflebită în venele sale femurale și poplitee drepte. Nivelul său de hemoglobină a fost de 8,6 g/dl, iar volumul corpuscular mediu a fost de 115 μm 3. Nivelul său de homocisteină plasmatică a fost de 200 μmol/l (normal 120), iar nivelul plasmatic de folat a fost normal. Aspirația măduvei osoase cu biopsie a arătat megaloblastoză (Fig. 1). Anticorpii împotriva celulelor parietale gastrice au fost pozitivi, în timp ce anticorpii împotriva factorului intrinsec au fost normali; o endoscopie a relevat gastrită atrofică fundală. Nicio altă anomalie nu a fost găsită într-un ecran mai detaliat pentru neoplasm sau boala Behçet. Testele anticorpilor antinucleari au fost negative.
Aspirația măduvei osoase a prezentat megaloblastoză
Tratamentul său a inclus terapie anticoagulantă administrată intravenos cu heparină, care a fost administrată ulterior pe cale orală. Vitamina B12 a fost administrată intravenos la o doză mare. În ziua 15, hemoglobina sa era de 10 g/dl. După o perioadă de urmărire de 6 luni, sub tratament cu cobalamină și anticoagulant administrat oral, valorile plasmatice ale hemoglobinei și ale homocisteinei sale au fost în intervalul normal. A rămas liber de evenimente trombotice pe parcursul a 4 ani de urmărire.
Cazul 4
O femeie marocană de 47 de ani s-a prezentat la unitatea spitalului nostru cu durere și umflături la piciorul stâng. Ea a fost deprimată și a avut o labilitate de dispoziție timp de 1 an și un istoric de accident vascular cerebral ischemic miocardic cu 2 ani înainte.
Un examen fizic a arătat semne de flebită la piciorul stâng. Radiografiile toracice și o electrocardiogramă nu au fost remarcabile. Hemoglobina ei a fost de 12 g/dl; volumul corpuscular mediu al acesteia a fost de 85 μm 3. Timpul ei de protrombină, timpul parțial de tromboplastină și nivelurile de fibrinogen au fost normale.
Ultrasonografia a relevat tromboflebită în vena ei stângă poplitee. Nu au existat dovezi clinice sau biologice de neoplazie, boală Behçet, sindrom antifosfolipidic, anomalie trombofilă sau lupus sistemic. Nivelul plasmatic de homocisteină a fost de 167 μmol/l (normal 120). Nivelul plasmatic al folatului a fost normal. De asemenea, a avut un număr normal de trombocite, niveluri normale de proteină C și proteină S și funcție normală de antitrombină III. Testarea genetică pentru mutația factorului V Leiden și mutația factorului II a fost negativă. Anticorpii împotriva factorului intrinsec au fost pozitivi. O endoscopie a relevat gastrită cronică și prezența Helicobacter pylori. Nicio altă anomalie nu a fost găsită într-un ecran mai detaliat pentru neoplasm sau boala Behçet. Tratamentul a inclus terapia anticoagulantă administrată oral și suplimentarea cu cobalamină, inițial parenterală. După o perioadă de urmărire de 3 ani, ea a rămas liberă de tulburări psihiatrice și evenimente trombotice. Nivelul ei de plasmă de homocisteină a fost în limitele normale.
Discuţie
Primul caz este original în sensul că manifestările psihiatrice și embolia pulmonară au fost primele manifestări ale anemiei pernicioase legate de hiperhomocisteinemie. După suplimentarea cu vitamina B12, anomaliile sale clinice și biologice au dispărut.
În cazul 4, accidentul vascular cerebral ischemic miocardic și depresia au fost probabil primele manifestări ale hiperhomocisteinemiei legate de anemia pernicioasă. De asemenea, cazurile 1 și 4 au prezentat tulburări psihiatrice care s-au rezolvat complet după suplimentarea cu vitamine. În literatură, manifestările psihiatrice sunt frecvent asociate cu anemie pernicioasă, inclusiv depresie, manie, psihoză și demență; aceste manifestări sunt observate în absența altor semne neurologice și hematologice bine recunoscute (similar cazului 4) timp de luni sau ani [17, 18].
Homocisteina este sintetizată prin două căi metabolice: remetilare și transsulfurare. Aceste căi necesită vitamina B12 și folat pentru sinteza metioninei și piridoxal-5 fosfat pentru sinteza cistationinei [5].
Hiperhomocisteinemia poate fi legată de defecte genetice, cum ar fi deficiența CBS sau varianta termolabilă a MTHFR, sau de deficiențele vitaminelor din grupul B înrudite.
S-a crezut că principala legătură fiziopatologică dintre aceste vitamine și tromboza venoasă este acumularea de homocisteină din cauza concentrațiilor scăzute ale acestor vitamine din grupul B. Cu toate acestea, toate aceste vitamine au un rol independent de homocisteină, legat de dezvoltarea trombozei venoase. În plus, hiperhomocisteinemia inhibă inactivarea factorului Va de proteina C activată și ar putea crește efectul factorului V Leiden [6, 19].
Hiperhomocisteinemia severă (> 100 μmol/L) este cel mai adesea cauzată de deficiența CBS. Hiperhomocisteinemia ușoară sau moderată poate rezulta dintr-un deficit relativ de acid folic și vitamina B12 și homozigoza pentru polimorfismul comun 677CT în MTHFR gena [20].
Anomalia metabolică moștenită poate fi suspectată atunci când pacienții prezintă episoade recurente de evenimente tromboembolice care apar la o vârstă fragedă sau tromboză în locuri neobișnuite.
Cazurile 2, 3 și 4 au prezentat hiperhomocisteinemie severă. Am suspectat o mutație genetică a MTHFR sau CBS sau alte mutații genetice, dar aceste teste nu au fost disponibile în spitalul nostru. Cu toate acestea, se poate presupune că pacienții noștri nu au avut aceste deficite, având în vedere prezentarea lor clinică și rezultatul favorabil numai în cazul suplimentării cu B12.
Deficiența CBS se caracterizează prin luxația lentilei, anomalii scheletice, tulburări neurologice și tromboembolism. Deficitul de MTHFR duce la diferite simptome neurologice, variind de la întârzierea dezvoltării până la encefalopatie, inclusiv anomalii motorii și ale mersului, convulsii, manifestări psihiatrice și, rareori, accidente vasculare cerebrale. Tratamentul CBS depinde de vitamina B6, în timp ce deficitul de MTHFR poate fi tratat eficient de vitamina B12, acid folic și betaină [5, 20].
Un studiu care a folosit datele din Studiul Național de Examinare a Sănătății și Nutriției (NHANES) între 1999 și 2002 a constatat că participanții cu deficit de vitamina B12 și folat seric crescut au crescut nivelurile de homocisteină comparativ cu participanții care aveau combinația de deficit de vitamina B12 și ser redus folat, sugerând un rol pentru nivelurile de folat în funcțiile enzimatice ale vitaminei B12 [20].
În cazurile noastre, speculăm că nivelurile normale de folat ar fi putut contribui la întârzierea diagnosticării anemiei pernicioase care duce la hiperhomocisteinemie severă și la consecința dezvoltării leziunilor vasculare și hipercoagulabilității. Cu toate acestea, absența istoricelor familiale pentru bolile aterotrombotice împreună cu normalizarea nivelurilor lor de homocisteină după suplimentarea parenterală cu vitamina B12 sugerează cu tărie că malabsorbția vitaminei B12 secundară anemiei pernicioase este cauza principală a hiperhomocisteinemiei severe.
Deficitul de vitamina B12, acid folic și vitamina B6 este asociat cu o creștere variabilă a nivelului de homocisteină [5, 21]. Rămâne neclar dacă hiperhomocisteinemia de cauze diferite implică același risc de tromboză.
Multe ipoteze au fost sugerate pentru a explica modul în care hiperhomocisteinemia poate duce la tromboză venoasă. O ipoteză este că homocisteinemia are un efect toxic asupra endoteliului vascular și asupra cascadei de puncte [1]. De asemenea, homocisteina are mai multe proprietăți procoagulante, inclusiv scăderea legării antitrombinei III la heparan sulfat endotelial, creșterea afinității între lipoproteina (a) și fibrină, inducerea activității factorului tisular în celulele endoteliale și inhibarea inactivării factorului V de către proteina activată C [22, 23].
Mai multe studii clinice au raportat creșteri mai frecvente ale homocisteinemiei la pacienții cu tromboză venoasă decât la martori [24]. Cu toate acestea, asocierea dintre hiperhomocisteinemie și tromboza venoasă rămâne controversată. Analizele multivariate ale unui studiu caz-control au arătat că concentrația scăzută de metionină și metilfolatul scăzut în celulele roșii din sânge, dar nu și homocisteina, au fost factori de risc de tromboză venoasă, sugerând că homocisteina este doar un marker al deficitului de vitamine [21]. Brattström și colab. [25] nu s-au găsit diferențe semnificative în concentrația plasmatică de homocisteină între participanții sănătoși de control și pacienții cu tromboembolism venos (TEV). Şoim și colab. [26] a raportat o prevalență ridicată a hiperhomocisteinemiei la pacienții cu vârsta sub 40 de ani care aveau TEV. Ducros și colab. [7] a arătat că hiperhomocisteinemia ușoară sau moderată nu pare a fi un factor determinant puternic în TEV. De asemenea, Ekim și colab. [6] a constatat o prevalență a hiperhomocisteinemiei (15%) la pacienții cu tromboză venoasă profundă. În acest studiu, au existat 26 de pacienți (43,3%) cu concentrație scăzută de folat, dintre care cinci au avut hiperhomocisteinemie. Acest studiu implică faptul că hiperhomocisteinemia și aportul scăzut de folat pot fi un factor de risc pentru tromboza venoasă profundă.
Cu toate acestea, nu se știe dacă terapia care reduce homocisteina, cum ar fi suplimentarea cu acid folic, vitamina B6 sau vitamina B12, poate modifica potențialul trombogen al hiperhomocisteinemiei în prevenirea trombozei venoase recurente [27].
În ciuda corelației scăzute dintre hiperhomocisteinemie și deficit de cobalamină și hiperhomocisteinemie și tromboză, cel puțin 20 de cazuri de tromboză venoasă în deficitul de vitamina B12 au fost publicate în literatură. Predominanța masculină este remarcabilă. În multe cazuri, hiperhomocisteinemia secundară anemiei pernicioase a fost descoperită de o tromboză. Pe lângă cazul primului nostru pacient, au fost publicate doar cinci cazuri [10, 13, 14, 28, 29] de anemie pernicioasă dezvăluită de embolie pulmonară.
De asemenea, au fost raportate alte stări de hipercoagulare asociate, cuprinzând anticorpi anticardiolipină, mutația factorului II, infecția HIV cu fibrinogen crescut, mutația factorului VIII și contracepția orală. Mecanismul de interacțiune dintre homocisteină și alți factori trombofili nu este clar. În toate cazurile raportate, nivelurile de homocisteină și cobalamină s-au normalizat după terapia cu cobalamină fără reapariția evenimentelor trombotice.
Cu toate acestea, scăderea nivelurilor ușor crescute de homocisteină la pacienții cu sau fără boli vasculare utilizând suplimentarea cu vitamine nu a arătat o reducere a evenimentelor cardiovasculare în mai multe studii clinice prospective și randomizate [30,31,32]. Creșterea severă a nivelului de homocisteină ar trebui corectată cu o terapie vitaminică adecvată pentru a preveni complicațiile vasculare [29].
Concluzii
Aceste cazuri demonstrează că deficiența de vitamina B12 cauzată de anemia pernicioasă poate duce la un nivel sever de homocisteină ridicat, care poate fi corectat rapid cu suplimente de vitamina B12 și poate preveni reapariția evenimentelor trombotice. Astfel, aceste afecțiuni ar trebui să rămână în mintea clinicianului, mai ales atunci când apare tromboza împreună cu anomalii biologice precum anemie, megaloblastoză sau hemoliză.
- Ce este tromboembolismul venos CDC
- Înțelegerea istoricului definițiilor de caz și a criteriilor Furnizorii de servicii medicale Myalgic
- The Glicemic Index Gi Diet Express pentru oamenii ocupați de Gallop, Rick Fine Paperback (2007) Mai întâi
- Dieta fără gluten nu uitați de nutriție! Shelley Case, RD
- Gut; axa creierului O nouă viziune patogenă a simptomelor neurologice; Descrierea unui caz pediatric