Subiecte
O corecție de autor a acestui articol a fost publicată la 16 martie 2020
Acest articol a fost actualizat
Abstract
Introducere
Expunerea la particule de aer ambiant cu substanțe fine (PM2.5) și ultrafine (PM 1. S-a stabilit că PM2.5 este derivat în principal din surse de combustie staționare și legate de trafic declanșează răspunsuri la stres inflamator asociat cu boli pulmonare obstructive cronice (BPOC) ), astmul și afecțiunile cardiovasculare 2,3,4 Studii recente au evidențiat importanța expunerii la poluarea aerului în potențarea riscului de boli metabolice precum diabetul de tip 2 (T2D) 5 și anomaliile metabolice 6,7,8 T2D este, într-adevăr, un factor principal al bolilor cardiovasculare 9 și susceptibilitatea la T2D pot reprezenta un mediator important, dar subapreciat, al riscului pe termen lung ca răspuns la expunerea la poluarea aerului. Studiile epidemiologice au demonstrat o asociere între expunere și rezistența la insulină (IR) și T2D 10. În plus, studiile de expunere controlată au descoperit un răspuns stereotip la poluarea aerului, cum ar fi gluconeogeneza hepatică excesivă, postul și post-prandial hiperglicemie, anomalii ale lipoproteinelor trigliceridice, steatoză hepatică și inflamație 11. De fapt, noi, precum și alți cercetători, am demonstrat rolul important pe care îl joacă poluarea aerului în steatohepatita nealcoolică și disfuncția ficatului gras (NAFLD) 12,13,14 .
În acest studiu am examinat efectele metabolice ca răspuns la expunerea sub-cronică (4 luni) la PM2.5 prin urmărirea 13 C6-glucoză la ficatul șoarecilor utilizând analiza metabolomică stabilă cu izotop rezolvat (SIRM). A fost de un interes deosebit să se studieze aceste efecte la un moment subcronic, spre deosebire de expunerea cronică, înainte de fenotipul stabilit al rezistenței la insulină 15. SIRM este o abordare recunoscută care permite analiza analizei rețelei metabolice pe baza modelelor de etichetare a atomilor de urmărire a numeroșilor metaboliți 16. Rezultatele noastre arată că tratamentul cu PM2.5 a redus glicoliza și ciclul Krebs, dar a îmbunătățit ramura oxidativă a căii pentozfosfatului (OxPPP), precum și datele care sugerează creșterea sintezei acizilor grași. Aceste modificări metabolice sunt similare cu cele observate în IR și T2D; prin urmare, poate fi responsabil pentru efectele dăunătoare asupra sănătății asociate cu expunerea la PM2.5 și dezvoltarea tulburării metabolice.
Rezultate
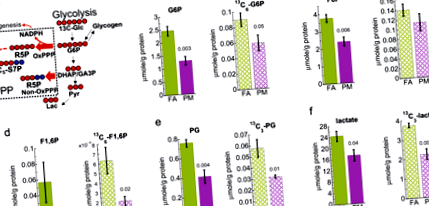
Scăderea glicolizei hepatice la șoarecii expuși PM2.5
Este interesant de remarcat faptul că nivelurile de 13 C-glicogen și glicogen nemarcat în ficat au fost semnificativ reduse la șoarecii expuși PM2,5 pe baza analizei RMN, așa cum se arată în Fig. 2a, b și figurile suplimentare. 5. Epuizarea 13-glicogenului, împreună cu scăderea glicolizei, indică sinteza atenuată a glicogenului și, astfel, scăderea depunerii de glicogen în ficat.
Analiza RMN 1 H arată că 13 C (A) și 12 C (b) glicogenul este redus în ficatul șoarecilor expuși la PM2,5 (PM) comparativ cu controlul aerului filtrat (FA). Barele de erori reprezintă o eroare standard. Student t-analiza testului datelor nepereche cu varianță egală (n = 5) și rezultat p-valorile afișate.
Expunerea la PM2.5 crește ramura oxidativă a căii pentozfosfatului
Apoi, am examinat încorporarea 13 C din 13 C-glucoză în PPP. Analiza IC-FTMS a arătat o creștere nesemnificativă a nivelurilor de fosforat 5-fosfat (R5P) și 13 C5-sedoheptuloză-7-fosfat (S7P) marcate, împreună cu o creștere atât a nivelurilor totale de fosforibosil pirofosfat (PRPP), cât și a celor 13 C la șoareci expuși PM2.5, așa cum este descris în Fig. 3a, b, d. În concordanță cu faptul că PRPP este donatorul de ribozil al sintezei de nucleotide, am observat o creștere semnificativă a 13 C5-ATP (Fig. 3c) în ficatul expus la PM2.5, care probabil prezintă 13 C5-riboză în ATP 18. Împreună, aceste rezultate susțin un flux crescut de carbon de la glucoză la ATP prin PPP. Mai mult decât atât, am observat epuizarea ATP neetichetat (12 C) la ficatul șoarecilor expuși la PM2,5 (Fig. 3c), care ar putea rezulta din scăderea glicolizei și a ciclului Krebs compromis (vezi mai jos).
Metaboliții căii pentozei fosfat (PPP) cuantificate prin IC-FTMS. Afișat este media sumei tuturor izotopologilor 13 C și 12 C (bare solide) și a sumei tuturor izotopologilor 13 C sau a celor 13 C specificin izotopolog așa cum este indicat în text (bare texturate). PM, PM2,5 expus; FA, control al aerului filtrat. R5P, riboză-5-fosfat; PRPP, fosforibozil pirofosfat; S7P, sedoheptuloză-7-fosfat. Barele de erori reprezintă o eroare standard. Student t-analiza testului datelor nepereche cu varianță egală (n = 4) și p-valorile prezentate considerate semnificative folosind procedura Benjamini-Hochberg (FDR = 0,1).
PPP constă din două brațe, nonOxPPP (Fig. 1a) și oxidativ (OxPPP), care produce R5P și NADPH. Creșterea substanțială a 13 C5-S7P și a nivelurilor totale de NADPH în PM2.5 față de ficatul expus la șoareci FA (Fig. 3d, e; cf. Fig. 1, schemă) este în concordanță cu OxPPP îmbunătățit probabil ca răspuns la ROS. Am măsurat, de asemenea, încorporarea a 13 C din glucoză în glutationul antioxidant (GSH) de către IC-FTMS și am constatat că atât GSH total cât și 13 C au fost reduse (Fig. 3f) la șoarecii expuși PM2.5 în ciuda acumulării de NADPH. Acest lucru sugerează compromisul capacității de sinteză a GSH, ceea ce duce la menținerea inadecvată a homeostaziei redox.
Dereglarea ciclului hepatic Krebs la șoarecii expuși PM2.5
Am demonstrat anterior anomalii marcate în structura mitocondrială ca răspuns la expunerea la PM2,5 15. Prin urmare, am examinat ficatul șoarecilor expuși PM2.5 și FA pentru intermediarii ciclului Krebs și încorporarea 13 C din 13 C6-glucoză (Fig. 4a). Introducerea a 13 carboni derivați din glucoză C6 în ciclul Krebs prin acetil-CoA are ca rezultat marcarea citratului cu 13 C2 (m + 2). 13 C2-citratul a fost redus semnificativ în ficatul expus la PM2.5 pe baza analizei IC-FTMS și GC-MS așa cum se arată în Fig. 4b și figurile suplimentare. 2b, respectiv. De asemenea, am observat marcarea redusă a 13 C2 a intermediarilor ciclului Krebs în aval de citrat, inclusiv succinat, fumarat și malat (Fig. 4c - e). Am măsurat nivelurile de 13 C2-aspartat ca metabolit surogat pentru oxaloacetat (OAA), deoarece OAA este foarte labil și dificil de măsurat direct. 13 C2-aspartatul a fost redus semnificativ la ficatul expus la PM2.5 (Fig. 4f). În plus, analiza IC-FTMS a intermediarilor 13 C3 (m + 3) (Fig. Suplimentară 3) sugerează scăderea intrării de la 13 C3-piruvat în ciclul Krebs prin carboxilarea piruvatului 19. În ciuda scăderii a 13 metaboliți ai ciclului Krebs derivat din glucoză C6, intermediarii totali ai ciclului Krebs nemarcat au fost nemodificați, cu excepția malatului și aspartatului, care au scăzut în ficatul PM2,5.
Creșterea lipogenezei hepatice la șoarecii expuși PM2.5
Unul dintre semnele distinctive ale IR și T2D este conversia îmbunătățită a glucozei în lipide 20. Citratul derivat din ciclul Krebs este un precursor al sintezei acizilor grași. Citratul este exportat din mitocondrii de către purtătorul de citrat mitocondrial (CIC) în citoplasmă, unde este lizat la OAA și acetil-CoA de către enzima ATP citrat liasă (ACLY, vezi Fig. 4a). Acetil-CoA participă apoi de novo sinteza acizilor grași cu palmitat fiind produsul final 21. Prin urmare, am examinat încorporarea glucozei derivate 13 C în palmitat de către GC-MS. În ciuda reducerii globale a glicolizei și a sintezei citratului, am detectat o îmbogățire totală crescută de 13 C în palmitat (Fig. 5a). în plus, de novo sinteza acizilor grași, care se reflectă prin îmbogățirea unităților de acetil marcate cu 13 C (derivate din glucoză de 13 C) în palmitat, a crescut semnificativ în ficatul expus la PM2,5 (Fig. 5b).
Creșteți palmitatul în ficatul șoarecilor expuși cronic la PM2,5. Analiza GC-MS indică faptul că palmitatul total (A) și de novo sinteza (b) este crescut în grupul expus PM2,5 (PM) comparativ cu aerul filtrat (FA). Barele de eroare reprezintă abaterea standard. Student t-analiza testului datelor nepereche cu varianță egală (n = 5).
Discuţie
Numeroase studii epidemiologice și studii de expunere controlată atât la modele umane, cât și la animale au demonstrat că expunerea la PM2.5 induce sindromul metabolic 22. Într-adevăr, noi și alții am demonstrat anterior un fenotip IR evident la șoareci expuși cronic timp de 10 luni 15 și subcronic timp de 10-17 săptămâni. Cu toate acestea, acesta din urmă a fost la șoareci care au primit suplimentar o dietă bogată în grăsimi, co-expunere la nichel sau un anumit fond genetic, care a exacerbat semnificativ fenotipul 11,23,24. În schimb, la expunerea subcronică timp de 3 luni sau mai puțin în condiții experimentale similare cu acest studiu (timpul de post și dieta), fenotipul IR nu a fost evident, fără nicio modificare a greutății corporale și a profilului de toleranță la glucoză 24.25. În consecință, fenotipul IR din modelul nostru animal a rezultat din expunerea cronică singură sau expunerea subcronică la PM2,5 atunci când este însoțită de alt factor de stres biologic sau de mediu.
Am demonstrat anterior o creștere a expresiei PEPCK, PGC1a și a defectelor în calea de semnalizare a insulinei hepatice-AKT-FoxO1 rezultând hiperglicemie evidentă și IR ca răspuns la inhalarea PM2.5 11,26. Acest studiu a urmărit să determine dacă anomaliile căilor metabolice din ficat preced dezvoltarea IR și T2D evidente prin examinarea modificărilor metaboliților metabolismului intermediar de la ficatul șoarecilor expuși la PM2,5 înainte de dezvoltarea IR și T2D (Fig. 4). Prin urmare, am efectuat o abordare stabilă a izotopilor 13 C stabiliți pentru a determina modul în care expunerea la PM2.5 modifică utilizarea glucozei în ficat înainte de dezvoltarea IR și T2D. Am arătat că expunerea la PM2.5 duce la modificări ale metabolismului hepatic asociate cu T2D și IR, chiar înainte de a detecta dovezi ale manifestării lor. Studiile anterioare pe țesuturi cardiace de la șoareci expuși la PM2.5 acut au arătat glicoliză redusă 27. De acord, am observat epuizarea produselor glicolitice marcate cu 13 C și totale (12 C + 13 C), inclusiv lactatul din ficatul șoarecilor expuși la PM2,5. Datele noastre sugerează că expunerea la PM2.5 are ca rezultat o activitate glicolitică hepatică scăzută derivată din precursorii glucozei și non-glucozei precum glicogenul.
Cu toate acestea, în ciuda nivelurilor reduse ale precursorului de 13 C-citrat, încorporarea 13 C în acizi grași a fost îmbunătățită. Acest lucru sugerează că 13-citratul C a fost epuizat parțial datorită utilizării sale îmbunătățite în de novo sinteza acizilor grași. Rezultatele noastre privind sinteza acizilor grași sunt în acord cu dezechilibrul sistemic raportat anterior al homeostaziei lipidelor după expunerea la PM10 43, în NAFLD 44 și la creșterea lipidelor din sânge după expunerea cronică la PM2,5 36. Într-adevăr, într-un stadiu târziu al progresiei către NASH sau T2D, respirația mitocondrială, sinteza ATP și rata de oxidare a lipidelor în ficat sunt compromise 45,46, ceea ce poate afecta semnalizarea insulinei și crește inflamația 47,48. Modul în care apar aceste modificări nu este cunoscut, totuși, am prezentat dovezi că un efect metabolic al expunerii la PM2.5 este oxidarea compromisă a glucozei compensată prin utilizarea combustibililor alternativi. În conformitate cu rezultatele noastre, efectele raportate ale expunerii acute la PM2,5 au fost scăderea ATP în cardiomiocite, scăderea acumulării de fumarat în ficat și plămâni 27,33,34,49. Cu toate acestea, am recunoscut că evaluarea noastră se limitează la metabolismul hepatic într-un singur punct de timp, ceea ce este insuficient pentru a descrie fără ambiguitatea cineticii și direcționalitatea reacțiilor metabolice.
Șoarecii expuși la PM2,5 nu au prezentat diferențe față de șoarecii expuși la aer filtrat în ceea ce privește schimbarea în greutate sau toleranța la glucoză în acest moment timpuriu timpuriu (Fig. Suplimentară 4). Prin urmare, afirmăm că arătăm că modificările metabolice preced debutul IR/diabet la șoarecii expuși PM2.5. Într-adevăr, rezultatele publicate anterior au arătat un dezechilibru redox la rinichi la șoareci expuși cronic la PM2,5 și un fenotip metabolic similar după expunerea acută în țesutul cardiac și celulele hepatice pe care cel raportat aici pentru ficat 27,61,62. Recunoaștem că o limită în studiul nostru este că bazele moleculare ale dereglării metabolice nu pot fi identificate, un subiect al cercetărilor viitoare. Cu toate acestea, rezultatele noastre sugerează o perspectivă asupra mecanismului; răspunsurile timpurii ale glicolizei atenuate, ciclului Krebs și sintezei GSH, precum și creșterea lipogenezei, induc un dezechilibru al capacității reductive în ficat, ducând la perturbarea homeostaziei redox în ficatul șoarecilor expuși PM2,5. poate duce la rândul său la inflamație, fibroză crescută și steatoză lipidică în ficat datorită ROS crescut și a dezvoltării ulterioare a IR și T2D 12,63,64,65,66 .
Materiale și metode
Animale
Șoarecii masculi C57BL/6J de șapte săptămâni au fost cumpărați de la Jackson Laboratories (Bar Harbor, ME) și au fost echilibrați timp de 2 săptămâni înainte de expunere. Toți șoarecii au fost adăpostiți în cuști cu dietă normală de chow la 21 ° C pe o oră de 12 ore. ușoară/12 ore. ciclu întunecat cu acces gratuit la apă și alimente. Protocoalele și utilizarea animalelor au fost aprobate de și în conformitate cu Comitetul de îngrijire și utilizare a animalelor (IACUC) de la Universitatea din Maryland (numărul de protocol 1113011) și Universitatea Johns Hopkins (numărul de protocol M013H134), Baltimore. Performanța tuturor experimentelor a urmat recomandările și liniile directoare de la IACUC, inclusiv toate metodologia și procedurile relevante pentru experimentarea șoarecilor în această cercetare.
Protocolul de inhalare a întregului corp ambiental
Șoarecii C57BL/6J au fost expuși la aer filtrat (FA) sau PM2.5 ambiant concentrat într-o remorcă mobilă situată pe campusul Universității din Maryland, Baltimore. PM2.5 concentrat a fost generat utilizând un sistem versatil de îmbogățire a concentrației de aerosoli (VACES) așa cum a fost descris anterior 67. Șoarecii au fost expuși la particule concentrate de PM2,5 timp de 6 ore pe zi, 5 zile pe săptămână pentru un total de 16 săptămâni. Grupul de control (șoareci expuși la FA) din experiment au fost expuși unui protocol identic cu toate particulele PM2.5 îndepărtate de un filtru de aer particule de înaltă eficiență poziționat în supapa de admisie. Concentrațiile medii de PM2,5 în perioada de expunere au fost de 8,7 ± 2,6 μg/m 3 în aerul înconjurător și de 62,5 ± 21,3 μg/m 3 în camera PM concentrată. Nivelurile medii de PM2,5 (± SD) în studiul actual (62,5 ± 21,3 μg/m 3) au fost similare în cadrul deviației standard raportului nostru anterior (69,6 ± 48,4 μg/m 3) de expunere subcronică de 3 luni și co-expunere cu nichel (Ni) 24. Compoziția chimică a amestecului PM2.5 din acest studiu nu este disponibilă, totuși un amestec într-un loc apropiat a fost caracterizat doi ani mai devreme 68 .
Protocol de testare a toleranței la glucoză intraperitoneală
Cu o săptămână înainte de sfârșitul perioadei de expunere, am efectuat o procedură raportată anterior pentru testul de toleranță la glucoză intraperitoneală (IPGTT) 15. Testul de toleranță la glucoză a necesitat șoareci la post timp de 12 ore (inclusiv șoarecii pe care i-am făcut injecția cu 13 C-glucoză), ceea ce are ca rezultat utilizarea normală a glucozei în ficat 69. Briefley, șoarecii au fost cântăriți și apoi injectați intraperitoneal cu glucoză (2 mg/kg greutate corporală). Probele de sânge au fost colectate prin vena cozii și concentrațiile de glucoză au fost măsurate înainte și la 30, 60, 90 și 120 de minute după injectare pe un glucometru Elite (Bayer, Leverkusen, Germania). Fig. Suplimentare. 5 raportează greutățile corpului, graficul IPGTT și aria de sub curbă calculată utilizând software-ul GraphPad cu eroare standard calculată (n = 10).
13 Administrarea glucozei C6 și recoltarea țesuturilor
În ziua următoare a expunerii finale, șoarecii au fost injectați intraperitoneal cu 13 C6-glucoză (Cambridge Isotopes Laboratories) conform protocolului descris de Fan și colab. cu modificarea 70. 80 pl (20 mg) de 13 C6-glucoză în PBS au fost injectate la 15 min. intervale de trei ori la șoareci au postit 12 ore. Timpul injectării a fost înregistrat și sângele a fost colectat înainte și după injectare. Țesuturile hepatice au fost colectate la 45 min. după prima injecție (15 min. după ultima injecție) și înghețată imediat (în termen de 5 minute de necropsie) în N2 lichid.
pregătirea unei mostre
Rezonanță magnetică nucleară (RMN)
Cromatografie ionică - spectrometrie de masă cu transformată fourier (IC-FTMS)
Disponibilitatea datelor
Datele care susțin rezultatele acestui studiu sunt disponibile la cerere pentru oricine are un interes public. Vă rugăm să trimiteți și să trimiteți un e-mail autorului corespunzător unde vă indicați în mod clar afilierile.
- Aminoacizii cu lanț ramificat exacerbează tulburările metabolice ale glucozei și lipidelor hepatice legate de obezitate
- Glucidele din nutriția peștilor afectează creșterea, metabolismul glucozei și enzimele hepatice - HEMRE
- Asocieri între profilurile metabolice ale aminoacizilor, lipidelor și glucozei la obezitatea infantilă BMC
- Deteriorarea CGI-58 la șoareci provoacă steatoză hepatică, dar previne obezitatea și glucoza induse de dietă
- Acumularea de PNPLA3 pe picături de lipide este baza steatozei hepatice asociate PNAS