Departamentul de Științe ale Sănătății, Universitatea Brock, Ontario, Canada
Departamentul de Științe ale Sănătății, Universitatea Brock, Ontario, Canada
Departamentul de Științe ale Sănătății, Universitatea Brock, Ontario, Canada
Corespondenţă
Rebecca E. K. MacPherson, Departamentul de Științe ale Sănătății, Universitatea Brock, St. Catharines, Ontario, Canada.
Tel: 905‐688‐5550 × 6620
Departamentul de Științe ale Sănătății, Universitatea Brock, Ontario, Canada
Departamentul de Științe ale Sănătății, Universitatea Brock, Ontario, Canada
Departamentul de Științe ale Sănătății, Universitatea Brock, Ontario, Canada
Corespondenţă
Rebecca E. K. MacPherson, Departamentul de Științe ale Sănătății, Universitatea Brock, St. Catharines, Ontario, Canada.
Tel: 905‐688‐5550 × 6620
Informații de finanțare:
Recunoaștem Consiliul de Cercetări în Științe Naturale și Inginerie din Canada (NSERC) pentru sprijinul financiar pentru finanțarea acestui proiect (RGPIN - 2017‐03904 REK MacPherson) și pentru finanțarea studiului original in vivo (RGPIN 2016‐04300 SJ Peters) în calitate de Fundație canadiană pentru inovare pentru finanțarea testului original in vivo (Grant # 222084 WE Ward). K.N. Bott a fost susținut de o bursă de studii pentru absolvenții din Ontario. B J. Baranowski a primit un premiu de cercetare universitară de la Consiliul de Cercetări în Științe Naturale și Inginerie din Canada (NSERC).
Abstract
Disfuncția metabolică legată de obezitatea indusă de dietă a fost recent legată de patogeneza bolii Alzheimer sporadice (AD). Cu toate acestea, mecanismele de bază care leagă obezitatea și AD rămân neclare. Scopul acestui studiu a fost de a examina modificările timpurii ale semnalizării insulinei cerebrale, markerilor inflamatori/stresului și stresului energetic într-un model de obezitate indusă de dietă în timpul vârstei medii. Șoarecii masculi C57BL/6J au fost randomizați fie la o dietă de control (AGE n = 12) sau dietă bogată în grăsimi și zaharoză (AGE - HFS n = 12) timp de 13 săptămâni de la vârsta de 20 de săptămâni. Probele de cortex prefrontal și hipocamp au fost colectate la vârsta de 20 de săptămâni (BSL n = 11) și la vârsta de 33 de săptămâni (VÂRSTĂ și VÂRSTĂ - HFS). Dieta HFS a dus la creșterea greutății corporale (30%; P = 0,0001),% crescut de masă grasă (28%; P = 0,0001) și scăderea% a masei slabe (33%; P = 0,0001) comparativ cu controalele în vârstă. În cortexul prefrontal, AGE - HFS a dus la o creștere a fosforilării proteinei kinazei activate cu 5 'adenozină monofosfat (AMPK) (P = 0,045). În hipocampus, AGE-HFS a dus la creșterea fosforilării kinazei reglementate de semnal extracelular (ERK) și a c-Jun N-kinazei terminale (JNK) și a serinei 473 a protein kinazei B (Akt) și a fosforilării glicogen sintazei kinazei (GSK) (P
Introducere
Boala Alzheimer (AD) este o tulburare neurodegenerativă progresivă care are ca rezultat un declin cognitiv mai târziu în viață. Îmbătrânirea este cel mai mare factor de risc pentru AD (Jorm și colab. 1987), cu toate acestea obezitatea indusă de dietă este direct implicată în etiologia AD (Lester-Coll și colab. 2006; Verdelho și colab. 2007; Maesako și colab. 2012a, b, 2013; Bhat și Thirumangalakudi 2013). O analiză recentă a tendințelor obezității a demonstrat că americanii de vârstă mijlocie au cea mai mare rată de obezitate din orice grup de vârstă la 41,0% (Flegal și colab. 2016), iar cercetările au dovedit că obezitatea la vârsta mijlocie poate fi un indice de afectare cognitivă ușoară anii ulteriori (Nguyen et al. 2014). Având în vedere lipsa actuală de tratamente eficiente pentru AD și considerând AD ca o boală metabolică, înțelegerea mecanismelor moleculare de bază care apar în etapele presimptomatice este de o importanță considerabilă.
AD se caracterizează prin două semnale histopatologice: (1) acumularea de plăci de proteină beta-amiloidă (Aβ); și (2) încurcături tau hiper-fosforilate (Behl și Holsboer 1998). Aceste peptide Aβ au fost stabilite ca actori cheie în degradarea neuronală care apare în AD (Gouras și colab. 2005) și joacă un rol fundamental în mecanismele de progresie timpurie a AD (Selkoe 2004; Gandy 2005). În ciuda abundenței informațiilor referitoare la fiziopatologia AD, evenimentele inițiale care declanșează formarea plăcii Aβ sunt slab înțelese. Aβ provine dintr-o proteină transmembranară de tip 1 mare, cunoscută sub numele de proteină precursoare amiloidă (APP) (Selkoe 2001). Calea β-secretazei este inițiată de enzima 1 de scindare a proteinei amiloid precursor beta-site (BACE1), enzima protează care limitează rata producției de peptide Aβ.
Dietele obezogene duc adesea la rezistență la insulină și la o stare de stres energetic în țesuturile periferice și dovezile indică faptul că obezitatea modifică și semnalizarea insulinei cerebrale și, la rândul său, starea energiei. Controlul aberant al semnalizării insulinei prin PI3-kinază și protein kinază B (Akt) a fost demonstrat în țesutul cerebral de la pacienții cu AD umană, precum și în creierele animale cu obezitate indusă de dietă. În probele de AD umane, Griffin și colab. (2005) au găsit o fosforilare Akt crescută, cu creșteri semnificative în fosforilarea mai multor substraturi Akt, inclusiv glicogen sintază kinază (GSK). Acest lucru este important, deoarece GSK a fost direct implicat în progresia AD. Munca rozătorilor a demonstrat o
Creșterea de 2 ori a fosforilării Akt în probele de cortex prefrontal de la șoareci masculi tineri C57BL6 (
16 săptămâni) după o dietă bogată în grăsimi (Macpherson și colab. 2015), precum și șoareci în vârstă după 5 luni de hrană bogată în grăsimi (Muller și colab. 2008). Creierul uman de la pacienții cu AD demonstrează AMPK activat anormal (Vingtdeux și colab. 2011; Ma și colab. 2014) și acest gând este un marker al metabolismului perturbat al energiei creierului. Influența îmbătrânirii și/sau a dietei asupra activității AMPK a creierului este slab înțeleasă. Puține studii s-au concentrat asupra efectului direct al îmbătrânirii sau al dietei obezogene asupra activității AMPK (așa cum se indică prin fosforilarea Thr172) și multe dintre ele sunt contradictorii cu constatările anterioare. Lucrările anterioare au demonstrat o scădere a activării AMPK odată cu vârsta la șobolanii masculi Fisher, în vârstă de 28 de luni, cu toate acestea, mecanismele rămân necunoscute (Reznick și colab. 2007). Se crede că aceste scăderi asociate vârstei în activitatea AMPK pot contribui la disfuncția mitocondrială (Jornayvaz și Shulman 2010), care a fost asociată cu patogeneza AD. Cu toate acestea, lucrările anterioare au stabilit că există o creștere a fosforilării AMPK într-un model de șoarece AD de 12 luni (APPswe/PS1d9E) în comparație cu tipul sălbatic (Ma și colab. 2014). Sunt necesare investigații suplimentare pentru a determina cu exactitate modul în care îmbătrânirea și o dietă bogată în grăsimi influențează activitatea și expresia AMPK.
Scopul acestui studiu este de a examina efectele unei diete obezogene asupra modificărilor metabolice ale creierului la șoarecii C57BL/6J masculi adulți, pe măsură ce trec de la vârsta adultă la vârsta mijlocie. Mai exact, acest studiu a examinat markerii inflamației/stresului celular, al semnalizării insulinei și al stresului energetic, care s-au dovedit a avea implicații în progresia AD. Ipotezăm că consumul unei diete bogate în grăsimi bogate în zaharoză va exacerba efectele îmbătrânirii asupra căilor metabolice legate de progresia AD.
Metode și materiale
Materiale
Anticorpii secundari IgG anti - iepure și capră conjugate cu măgari peroxidază de hrean au fost de la Jackson ImmunoResearch Laboratories (Westgrove, PA). Markerul de greutate moleculară, reactivii și membranele de nitroceluloză pentru SDS - PAGE au fost achiziționate de la Bio - Rad (Mississauga, ON). Western Lightning Plus-ELC (PerkinElmer, 105001EA). Anticorpi pentru GAPDH (# 2118S), BACE1 (# 5606P), AMPK (# 2793S), pAMPK (# 2531S), AKT (# 4685S), pAKT S473 (# 4058S), pAKT Thr172 (# 2531S), ERK 1/2 (# 4695S), pERK 1/2 (# 9101S), p38 (# 9212S), p - p38 (# 9211S), JNK (# 9252S), pJNK (# 4671S), GSK - 3β (# 9315S) și pGSK- 3β (# 5558S) provin de la Cell Signaling (Danvers, MA, SUA), iar Vinculin (# 05-386) provine din Milipore. Toate celelalte surse sunt listate în text.
Animale
Protocoalele experimentale au fost aprobate de Comitetul pentru îngrijirea animalelor de la Universitatea Brock (dosarul nr. 15-06-01) și sunt în conformitate cu Consiliul canadian pentru îngrijirea animalelor. Animalele și designul experimental sunt cele dintr-un studiu recent publicat de la Universitatea Brock (Bott et al. 2017). Șoareci masculi C57BL/6J (19 - săptămâni; 26,9 ± 1,9 g, n = 35) au fost achiziționate de la Laboratorul Jackson (Bar Harbor, Maine, SUA) și li s-a permis să se aclimatizeze timp de 5 zile în Facilitatea de Biosștiințe Comparative a Universității Brock. În timpul aclimatizării, șoarecii au fost hrăniți cu chow standard (2014 Teklad dieta de întreținere a rozătoarelor la 14% la nivel global, Harlan Tekland, Mississauga, ON). După aclimatizare, șoarecii au fost randomizați până la momentul inițial (BSL, n = 11), controlează dieta și îmbătrânirea (AGE, n = 12), sau dietă bogată în grăsimi - zaharoză coroborată cu îmbătrânirea (AGE - HFS, n = 12). Toți șoarecii au fost ținuți la o lumină de 12 ore: un ciclu de întuneric de 12 ore și au avut acces ad libitum la alimente și apă prin întregul studiu.
Proiectare experimentală
Colecția de țesuturi
Șoarecii au fost anesteziați cu 5% izofluran (CDMV). Șoarecii au fost eutanasiați prin exsanguinare prin tăierea aortei și a venei cave. Colecția de regiuni specifice creierului (cortexul prefrontal stâng și drept și hipocampus) au fost disecate în conformitate cu Spijker (2011). Pe scurt, foarfecele chirurgicale au fost folosite pentru a îndepărta capul cu o tăietură posterioară urechilor și a fost făcută o incizie a liniei medii pentru a îndepărta pielea pentru a expune craniul. O mică incizie a fost apoi făcută la baza osului parietal și apoi tăiată în partea cea mai anterioară a craniului (adică osul frontal). Forcepsele au fost apoi folosite pentru a curăța spatele și a rupe ambele părți ale osului parietal. Odată ce creierul a fost descoperit, foarfecele chirurgicale curbate (închise) au fost alunecate sub partea posterioară a creierului și ridicate ușor. Foarfeca a fost apoi folosită pentru a tăia nervii cranieni, eliberând creierul. Odată ce creierul a fost scos din craniu, s-a folosit un bisturiu chirurgical pentru a diseca creierul în emisferele stânga și dreapta. Odată izolate în părțile respective, s-au îndepărtat cortexul prefrontal stâng și drept și hipocampul. Probele au fost congelate rapid în azot lichid și depozitate la -80 ° C pentru analiza Western blot.
Western blot
analize statistice
Diferențele în conținutul de proteine și fosforilare au fost determinate folosind ANOVA unidirecțional, urmată de un test post hoc al lui Tukey. A fost efectuat un test Shapiro-Wilk pentru normalitate și în cazurile în care datele nu au fost distribuite în mod normal, datele au fost transformate logaritmic. O valoare de P
Rezultate
Greutatea corporală și compoziția
Datele privind greutatea corporală și compoziția corpului au fost raportate anterior (Bott et al. 2017). Pe scurt, înainte de intervenția dietetică nu au existat diferențe în greutatea corporală între grupuri (BSL, AGE, AGE - HFS). După intervenția de 13 săptămâni de dietă/vârstă, grupul AGE-HFS a avut o masă corporală cu 30% mai mare decât grupul AGE (P = 0,0001). Atât grupurile AGE cât și AGE - HFS au avut o creștere a masei grase (P = 0,0001), totuși AGE - HFS a avut o creștere mai mare (79%) în comparație cu AGE (51%; P = 0,0001). O scădere a masei slabe a fost observată atât la vârsta, cât și la vârsta - HFS (P = 0,0001), totuși AGE - HFS a avut o scădere mai mare a masei slabe (46%) în comparație cu AGE (13%; P = 0,001). Rezultatele demonstrează eficiența dietei HFS pentru a induce o stare de obezitate.
Markeri de inflamație/stres celular
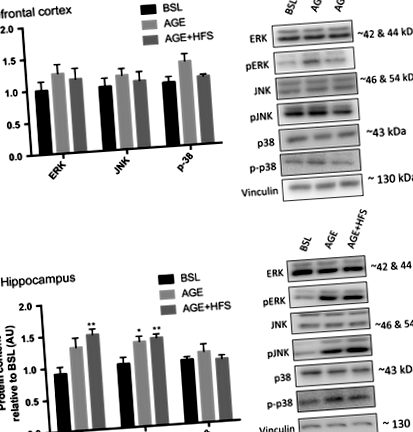
Se consideră că MAPK este una dintre căile majore implicate în progresia AD datorită rolului lor în diferite mecanisme; de exemplu, apoptoza neuronală crescută, activarea crescută a BACE1 și fosforilarea APP (Hashimoto și colab. 2003; Marques și colab. 2003; Puig și colab. 2004). S-au examinat modificările conținutului total și fosforilat ale fiecărei sub-familii MAPK. Nu au existat diferențe în conținutul total de proteine p38, ERK sau JNK în toate grupurile din cortexul prefrontal și hipocampus. Nu au existat diferențe între grupuri pentru pERK, pJNK sau fosfo - p38 în cortexul prefrontal (Fig. 1A). În hipocampus, a existat un conținut de pERK semnificativ mai mare în grupul AGE - HFS comparativ cu BSL și AGE (P = 0,02). Atât grupurile AGE, cât și AGE - HFS au avut un conținut de proteine pJNK mai mare comparativ cu BSL (Fig. 1B) (P = 0,005).
Markeri de rezistență la insulină
Dovezile sugerează că bolile legate de obezitate, datorate rezistenței la insulină, contribuie la procesele neurodegenerative precum AD (Bigornia și colab. 2012; Candeias și colab. 2012). Atât în cortexul prefrontal, cât și în hipocampus nu s-au observat diferențe în conținutul total de proteine Akt sau GSK-3β. Cortexul prefrontal a demonstrat fosforilare Akt serină 473 mai mare atât în grupurile AGE, cât și în grupele AGE - HFS comparativ cu BSL (P = 0,03) fără diferențe în fosforilarea Akt treoninei 308 sau fosforilarea GSK-3β (Fig. 2A). Hipocampul a demonstrat fosforilare Akt serină 473 mai mare atât în grupurile AGE, cât și în grupele AGE - HFS comparativ cu BSL (P = 0,0008) fără diferențe în fosforilarea treoninei 308 Akt. Mai mult, în hipocampus a existat o fosforilare GSK-3β mai mare în grupul AGE-HFS comparativ cu BSL (Fig. 2B) (P = 0,002).
Markeri ai stresului energetic
AMPK este un marker al metabolismului perturbat al energiei cerebrale și este activat anormal în AD (Vingtdeux și colab. 2011; Ma și colab. 2014). S-a constatat că AMPK suplimentară crește conținutul și activitatea proteinei BACE1 (Chen și colab. 2009). În cortexul prefrontal nu au existat diferențe în conținutul total de AMPK între grupurile experimentale; cu toate acestea, a existat un conținut mai mare de AMPK fosforilat în AGE - HFS comparativ cu BSL și AGE (P = 0,045) (Fig. 3A). În hipocampus, nu au existat diferențe semnificative în AMPK total sau fosforilat (Fig. 3B).
Prelucrarea proteinelor precursoare amiloide
BACE1 este considerat a fi un biomarker pentru detectarea și predicția AD (Hampel și Shen 2009). Pentru a examina efectele îmbătrânirii și îmbătrânirii cu o dietă bogată în grăsimi/zaharoză asupra markerilor de progresie precoce a AD, s-au măsurat modificările în conținutul total de proteine BACE1, APP și sAPPβ. În cortexul prefrontal (Fig. 4A), nu au existat modificări semnificative statistic în conținutul BACE1, APP total sau sAPPβ în niciun grup. În hipocampus, nu s-au detectat modificări ale conținutului BACE1, APP total sau sAPPβ (Fig. 4B).
Discuţie
Acest studiu oferă o perspectivă nouă asupra modificărilor timpurii care apar în creier ca răspuns la o dietă HFS în timpul tranziției de la vârsta adultă la vârsta mijlocie la șoarecii masculi. Rezultatele noastre demonstrează că singura tranziție la vârsta mijlocie are ca rezultat fosforilarea hipocampică JNK și Akt Ser473 mai mare și că îmbătrânirea în această perioadă în timp ce consumă dieta HFS are ca rezultat o fosforilare JNK și Akt Ser473 hipocampică mai mare, precum și fosforilarea ERK și GSK-3β. Mai mult, în cortexul prefrontal, dieta HFS a dus la creșterea fosforilării AMPK, care indică stres energetic. Aceste rezultate evidențiază neuroinflamarea/stresul, semnalizarea modificată a insulinei cerebrale și stresul energetic crescut ca modificări importante ale creierului cu obezitate indusă de dietă la vârsta medie. Această lucrare avansează cunoștințele noastre actuale despre mecanismele și căile de bază care pot duce la patologii legate de AD în stadiile incipiente ale bolii. Rezultate noi suplimentare din această lucrare demonstrează diferențe specifice regiunii între cortexul prefrontal și hipocampus ca răspuns la îmbătrânirea cu o dietă HFS, indicând faptul că patologia bolii nu este uniformă în tot creierul.
În plus față de creșterea markerilor de stres inflamator/celular și modificarea semnalizării insulinei, grupul AGE-HFS a demonstrat, de asemenea, fosforilarea crescută a AMPK în cortexul prefrontal. Aceste descoperiri susțin ipoteza că îmbătrânirea și îmbătrânirea suprapuse cu o dietă HFS cresc stresul energetic neuronal și sunt în acord cu studiile anterioare (Vingtdeux și colab. 2011; Ma și colab. 2014; Macpherson și colab. 2015). Nu au existat modificări ale fosforilării AMPK în hipocamp, indicând astfel diferențe regionale în răspunsul la o dietă obezogenă. Răspunsurile diferite ale cortexului prefrontal și ale hipocampului la îmbătrânire și la HFS se pot datora diferențelor în metabolismul energetic între cele două regiuni sau pot indica un curs diferit în evoluția bolii. Sunt necesare eforturi suplimentare pentru a examina aceste diferențe regionale.
Concluzii
Acest studiu oferă informații noi în legătură cu legătura mecanicistă dintre obezitate și tranziția de la vârsta adultă la vârsta medie și cascadele de semnalizare care pot fi legate de patologia AD mai târziu în viață. Rezultatele noastre demonstrează că îmbătrânirea combinată cu o dietă HFS exacerbează efectele îmbătrânirii asupra inflamației/stresului (fosforilarea ERK și JNK) în hipocampus și a stresului energetic în cortexul prefrontal. Astfel de adaptări în cortexul prefrontal versus regiunile hipocampice sugerează că patologia bolii nu este uniformă în tot creierul. Mai mult, dieta HFS a dus la o fosforilare mai mare a Akt Ser473 atât în cortexul prefrontal, cât și în hipocamp. Aceste rezultate se adaugă la înțelegerea noastră de bază asupra căilor implicate în progresia timpurie a patogenezei AD și demonstrează efectele negative ale unei diete HFS atât asupra cortexului prefrontal, cât și a regiunilor hipocampice.
Mulțumiri
Autorii îi mulțumesc doctorilor. Sandra J. Peters și Wendy Ward pentru asistența lor la acest experiment.
- Dieta combinată bogată în grăsimi și un consum susținut ridicat de zaharoză promovează NAFLD într-un model murin -
- Efectul dietei timpurii de zaharoză asupra preferinței și comportamentului etanolului la șobolanii Wistar masculi și feminini
- Efectele preadipocitelor derivate de la șoareci hrăniți cu o dietă bogată în grăsimi asupra potențialului angiogen al
- Efectele dietei larvelor asupra ratelor de dezvoltare și a maturizării reproducerii la bărbați și femei
- Efectul tărâței de orez nesaponificabile asupra dietei bogate în grăsimi - obezitatea indusă la șoareci - Șuncă - 2015 - Jurnal