Ping Jiao
1 Hallett Center for Diabetes and Endocrinology, Rhode Island Hospital, Warren Alpert Medical School of Brown University, Providence, RI 02903, SUA
2 Școala de științe farmaceutice, Universitatea Jilin, Changchun, provincia Jilin, China
Bin Feng
1 Hallett Center for Diabetes and Endocrinology, Rhode Island Hospital, Warren Alpert Medical School of Brown University, Providence, RI 02903, SUA
Yujie Li
1 Hallett Center for Diabetes and Endocrinology, Rhode Island Hospital, Warren Alpert Medical School of Brown University, Providence, RI 02903, SUA
Qin He
1 Hallett Center for Diabetes and Endocrinology, Rhode Island Hospital, Warren Alpert Medical School of Brown University, Providence, RI 02903, SUA
Haiyan Xu
1 Hallett Center for Diabetes and Endocrinology, Rhode Island Hospital, Warren Alpert Medical School of Brown University, Providence, RI 02903, SUA
Abstract
1. Introducere
2. Materiale și metode
2.1. Reactivi și celule
Anticorpii fosfo-ERK, tERK și MEK1 au fost achiziționați de la semnalizarea celulară (Danvers, MA). Anticorpul tubulin a fost achiziționat de la Abcam (Cambridge, MA). Anticorpul MKP-3 a fost achiziționat de la Santa Cruz Technology (Santa Cruz, CA). Celulele Fao au fost furnizate de Dr. Zhidan Wu (Novartis Institutes for Biomedical Research) și cultivat în RPMI 1640 suplimentat cu 10% ser fetal bovin (Xu și colab., 2005).
2.2. Extracția ARN și analiza PCR în timp real
Probele de ARN au fost extrase din țesuturi folosind reactivul TRIzol (Invitrogen, Carlsbad, CA) conform instrucțiunilor producătorului. Probele de ARN tratate cu DNază I au fost transcrise invers cu transcriptază inversă SuperScript III (Applied Biosystems, Carlsbad, CA) și hexameri aleatori (Invitrogen) pentru a genera ADNc. Analiza PCR în timp real a fost efectuată utilizând reactivul Power SYBR Green RT-PCR (Applied Biosystems) pe ciclorul termic ABI Prism model StepOnePlus (Applied Biosystems). Fiecare reacție de 15 ul PCR conținea 1 × amestec de reacție, 5,5 mM MgSO4, 300 nM primer înainte și 300 nM primer invers. Programul de ciclare termică a fost de 50 ° C timp de 2 minute, urmat de 95 ° C timp de 10 minute timp de 1 ciclu, apoi de 95 ° C timp de 15 secunde, urmat de 60 ° C timp de 1 minut timp de 40 de cicluri. Analiza curbei de topire a fost efectuată pentru a asigura specificitatea primerilor. ARNr 28S a fost utilizat ca genă de referință în fiecare reacție. Secvențele primerilor PCR în timp real sunt următoarele:
PEPCK 5 ’CTGCATAACGGTCTGGACTTC, 3’ CAGCAACTGCCCGTACTCC
G6Pase 5 ’CGACTCGCTATCTCCAAGTGA, 3’ GTTGAACCAGTCTCCGACCA
MKP-3, 5 ’ATAGATACGCTCAGACCCGTG, 3’ ATCAGCAGAAGCCGTTCGTT
FAS, 5 ’GGCTCTATGGATTACCCAAGC, 3’ CCAGTGTTCGTTCCTCGGA
ACC1, 5 ’CGGACCTTTGAAGATTTTGTGAGG, 3’ GCTTTATTCTGCTGGGTGAACTCTC
ACC2, 5 ’GGAAGCAGGCACACATCAAGA, 3’ CGGGAGGAGTTCTGGAAGGA
PPARα 5 ’AGAGCCCCATCTGTCCTCTC, 3’ ACTGGTAGTCTGCAAAACCAAA
CPT-1β 5 ’GCACACCAGGCAGTAGCTTT, 3’ CAGGAGTTGATTCCAGACAGGTA
VLCAD 5 ’TCAGGTGTTCCCATACCCATC, 3’ AAGGCGTCGTTCTTGGCAG
2.3. Analiza Western blot
Țesuturile și celulele au fost omogenizate și lizate cu tampon de liză rece cu gheață suplimentat cu inhibitori de protează. Lizatele de proteine au fost separate pe gel Bis-Tris-PAGE 4-12%, transferate pe membranele de difluorură de poliviniliden urmate de blocarea timp de 60 de minute în 1% albumină serică bovină/1 × soluție salină tamponată Tris cu Tween-20 (TBST) sau 5% lapte uscat fără grăsime/1 × TBST. Membranele au fost apoi incubate cu anticorpii primari corespunzători în prezența 1% albumină serică bovină/1 × TBST sau 5% lapte uscat fără grăsime/1 × TBST peste noapte pe un rocker la 4 ° C. După spălări aprofundate în 1 × TBST, membranele au fost expuse la anticorpi secundari corespunzători legați la peroxidază de hrean în 5% lapte uscat fără grăsime/1 × TBST timp de 1 oră la temperatura camerei. După spălări aprofundate în 1 × TBST, semnalele au fost detectate cu o soluție de detectare a Western blot de chemiluminescență (PerkinElmer, Waltham, MA) pe sistemul de imagistică fluorochimică Alpha-Inotech.
2.4. Construcția și purificarea adenovirusului
2.5. Întreținerea și analiza șoarecilor
2.6. Teste de toleranță la glucoză și insulină
Pentru testul de toleranță la glucoză (GTT), șoarecii au fost postiti peste noapte și apoi injectați cu glucoză la doza de 2g/kg pentru șoareci masculi hrăniți cu chow sau la doza de 0,75g/kg pentru șoareci DIO. Nivelurile de glucoză din sânge au fost măsurate la 0, 15, 30, 45, 60 și 90 de minute după injectare. Pentru testul de toleranță la insulină (ITT), șoarecii au fost posti timp de 6 ore și injectați cu insulină la doza de 0,5 U/kg pentru șoarecii masculi hrăniți cu chow și 1,5 U/kg pentru șoarecii DIO. Nivelurile de glucoză din sânge au fost măsurate la fiecare 15 minute până la 90 de minute după injectare.
2.7. Calorimetre indirecte
Consumul de oxigen (VO2), producția de dioxid de carbon (VCO2) și aportul de alimente au fost măsurate individual timp de 24 de ore utilizând sistemul cuprinzător de monitorizare a animalelor de laborator (Columbus Instruments, Columbus, OH) după o zi de aclimatizare. În timpul experimentului, șoarecii au avut acces gratuit la alimente și apă. Cheltuielile de energie au fost calculate utilizând următoarea formulă: VO2 × (3,815 + 1,232 × RQ) și normalizate în raport cu greutatea corporală a animalului și corectate în funcție de o valoare efectivă a masei, care este masa corporală 0,75 .
2.8. Analiza histologică
Țesuturile hepatice au fost fixate în 10% formalină tamponată neutru timp de o zi, apoi transferate în etanol 70% și parafină încorporate. Colorarea glicogenului (PAS) a fost făcută la laboratorul central al Spitalului Rhode Island.
2.9. Măsurarea conținutului de trigliceride (TAG) și de acizi grași liberi (FFA)
Conținutul TAG hepatic a fost determinat folosind omogenate de ficat. Țesuturile congelate au fost cântărite, pulverizate în azot lichid, omogenizate în etanol, vortexate, centrifugate și supernatantul a fost colectat pentru măsurare. Standardele TAG sau probele au fost amestecate cu tamponul de reacție (100mM Tris, pH7,4, 1mM MgCl2, 0,05mM ATP, 0,2U/ml peroxidază de ridiche de cal, 1U/ml glicerol fosfat oxidază, 2U/ml glicerol kinază, 25U/ml lipază, și 0,05mM Amplex roșu) și incubat timp de 30 de minute la 37 ° C. Pentru măsurarea conținutului de FFA din plasmă, standardele FFA sau probele au fost amestecate cu tamponul de reacție (100mM Tris, pH7,4, 1mM MgCl2, 0,05mM ATP, 0,2 U/ml peroxidază de ridiche de cal, 0,05U/ml acil CoA sintetază, 0,05U/ml acil CoA oxidază, 0,04mM CoA, 0,004mM FAD și 0,05mM Amplex roșu) și incubate timp de 30 de minute la 37 ° C. Fluorescența a fost citită la excitație 530nm/emisie 590nm folosind cititorul de plăci Synergy 4 (BioTek Instruments, Winooski, VT).
2.10. Izolarea adipocitelor primare
Șoarecii au fost postiti peste noapte și adipocitele primare au fost obținute din plăci gonadale gonadale așa cum s-a descris anterior (Feng și colab., 2011; Jiao și colab., 2011). Pe scurt, adipocitele au fost izolate din tampoanele de grăsime gonadală ale șoarecilor prin digestie cu colagenază (1 mg/ml, tip I). Tampoanele de grăsime gonadală au fost disecate, ponderate, clătite și tăiate în bucăți mici în tampon de izolare. Tampoanele de grăsime tocate au fost digerate la 37 ° C timp de 30 de minute și apoi filtrate prin plasă de 380 uM pentru a obține suspensie cu celule unice. După centrifugare la 1000 rpm, adipocitele plutitoare au fost colectate și clătite de două ori cu tampon de izolare.
2.11. Lipoliza în adipocite izolate
Adipocitele izolate au fost incubate în tampon de izolare plus vehicul sau 1 uM izoproterenol timp de 1 oră. Probele au fost centrifugate și supernatantele au fost încălzite la 80 ° C. Pentru măsurarea eliberării glicerolului, standardele de glicerol sau probele au fost amestecate cu tamponul de reacție (100mM Tris, pH7,4, 1mM MgCl2, 0,05mM ATP, 0,2 U/ml peroxidază de ridiche de cal, 1U/ml glicerol fosfat oxidază, 2U/ml glicerol kinază, și 0,05mM Amplex roșu) și incubat timp de 30 de minute la 37 ° C. Fluorescența a fost citită la excitație 530nM/emisie 590nM utilizând cititorul de plăci Synergy 4.
2.12. Localizarea nucleară a proteinei de fuziune FOXO1-GFP
Celulele Fao au fost infectate cu adenovirus care exprimă β-gal sau MEK CA pe plăci cu 12 godeuri. Douăzeci și patru de ore mai târziu aceste celule au fost transfectate cu pcDNA-FOXO1-GFP. Patruzeci și opt de ore după transfecție, celulele au fost incubate în mediu fără ser timp de șaisprezece ore, apoi incubate în DMEM fără glucoză, fără ser, suplimentat cu 1xM dexametazonă, 2mM purivat și 20mM lactat timp de încă trei ore. Celulele au fost apoi fixate în 10% formalină timp de 30 de minute la temperatura camerei și incubate cu 1 ug/ml DAPI timp de 1 oră la 37 ° C. Fotografiile au fost făcute din puțuri de replică. Procentul de localizare nucleară FOXO1 a fost calculat prin împărțirea numărului de celule verzi cu localizare nucleară predominantă la numărul total de celule verzi.
2.12. analize statistice
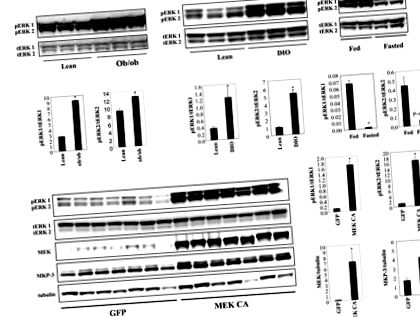
Rezultatele sunt prezentate ca medie ± SEM. Semnificația statistică a fost determinată la P Figura 1A). Creșterea fosforilării ERK la ficatul șoarecilor DIO apare în etapa ulterioară a dezvoltării obezității, deoarece fosforilarea ERK la ficatul șoarecilor DIO hrăniți cu o dietă bogată în grăsimi timp de șaisprezece săptămâni nu a avut o creștere semnificativă (datele nu sunt prezentate). Fosforilarea ERK1/2 în ficatul șoarecilor slabi poate fi redusă prin post (Figura 1A), indicând un rol ca răspuns la modificările stării energiei.
A. Nivelurile de fosforilare ale ERK1/2 la ficatul șoarecilor masculi ob/ob și DIO față de controalele slabe (n = 3 fiecare grup, șoarecii DIO au urmat o dietă bogată în grăsimi timp de 24 de săptămâni) și la ficatul șoarecilor slabi hrăniți sau la post = 2 fiecare grup). B. Expresie excesivă a MEK1 activ constitutiv (MEK CA) la ficatul șoarecilor C57BL/6 masculi slabi (n = 7 fiecare grup). Șoarecii au fost sacrificați la șapte zile după injectarea virusului în stare de post. * P Figura 1B). Expresia proteinei MKP-3, o fosfatază MAP kinază cu o specificitate ridicată pentru ERK, este semnificativ crescută datorită unui potențial mecanism de feedback negativ pentru a restricționa activitatea ERK (Figura 1B). Activarea ERK hepatică constitutivă timp de șapte zile nu a afectat greutatea corporală sau nivelul glicemiei postprandiale, dar a crescut semnificativ nivelul glicemiei în post și greutățile hepatice (Figura 2A).
Șoarecii au fost sacrificați la șapte zile după injectarea virusului. A. Efect asupra expresiei genelor implicate în gluconeogeneză. B. Efect asupra expresiei genelor implicate în sinteza lipidelor. C. Efect asupra expresiei genelor implicate în oxidarea acizilor grași. * P Figura 4A - B). Adipocitele izolate de la șoareci injectați cu Ad-MEK CA au prezentat o activitate lipolitică mai mare atât în condiții bazale, cât și în condiții stimulate de izoproterenol (Figura 4C). Creșterea lipolizei este probabil principalul factor care contribuie la creșterea nivelului de FFA circulant și la scăderea masei adipoase la șoareci cu activare ERK constitutivă în ficat pentru o perioadă mai lungă de timp. Studiul cuștii metabolice a relevat scăderea consumului de oxigen, scăderea emisiilor de dioxid de carbon, scăderea consumului de energie și scăderea aportului de alimente la șoarecii injectați cu Ad-MEK CA comparativ cu șoarecii administrați cu Ad-GFP (Figura 5). Temperatura miezului corpului a fost, de asemenea, semnificativ mai scăzută la șoarecii injectați cu Ad-MEK CA în stare hrănită și în tendințe descendente în stare de post (Figura 5).
A Activarea ERK hepatică și efectul asupra toleranței la insulină (n = 6-7 fiecare grup). Adenovirusurile care exprimă GFP sau MEK CA au fost injectate la doza de 5 × 10 11 particule pe șoarece. * P Figura 7A). Sensibilitatea la insulină și toleranța la glucoză au fost îmbunătățite semnificativ la șoarecii DIO injectați cu adenovirus care exprimă shERK1/2 comparativ cu șoarecii martor care exprimă shGFP (Figura 7B), indicând faptul că activitatea ERK hepatică endogenă în obezitate contribuie la rezistența sistemică la insulină. Conținutul de glicogen hepatic a fost redus semnificativ la șoarecii DIO injectați cu adenovirus care exprimă shERK1/2 comparativ cu șoarecii DIO de control injectați cu shGFP (Figura 7C), dar conținutul TAG hepatic nu a fost modificat prin semnalizarea ERK atenuată. Nivelurile FFA circulante au fost, de asemenea, reduse semnificativ la reducerea activității hepatice ERK, sugerând un mecanism potențial pentru îmbunătățirea sensibilității la insulină (Figura 7C).
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Mama; cu stilul de viață joacă un rol important în copil; cu Obesity Risk MedPage Today
- Dieta Keto joacă un rol cheie în startup care pretinde că inversează diabetul - Business Insider
- Starea menopauzei și obezitatea abdominală sunt factori determinanți semnificativi ai metabolizării lipidelor hepatice în
- Există vreo asociere între excesul de greutate, activitatea fizică, aportul de grăsimi și fibre cu
- Preocupare pentru sănătate, motive de alegere a alimentelor și atitudini față de alimentația sănătoasă Rolul mediator al alimentelor