Laboratoarele Gifford, Centrul pentru Cercetarea Diabetului, Departamentul de Medicină Internă, Universitatea din Texas Southern Medical Center, Dallas 75235; și
Laboratoarele Gifford, Centrul pentru Cercetarea Diabetului, Departamentul de Medicină Internă, Universitatea din Texas Southern Medical Center, Dallas 75235; și
Laboratoarele Gifford, Centrul pentru Cercetarea Diabetului, Departamentul de Medicină Internă, Universitatea din Texas Southern Medical Center, Dallas 75235; și
Laboratoarele Gifford, Centrul pentru Cercetarea Diabetului, Departamentul de Medicină Internă, Universitatea din Texas Southern Medical Center, Dallas 75235; și
Centrul Medical al Departamentului Veteranilor, Dallas, Texas 75216
Abstract
Conținutul de trigliceride tisulare (TG) părea să fie un candidat plauzibil pentru acest rol dublu. Acizii grași liberi cu lanț lung (FFA) se știu de multă vreme că interferează cu metabolismul glucozei mediat de insulină (2, 8, 13, 15,18, 24, 25, 29) și stimulează secreția de insulină acut (5, 11, 22, 26, 31). Mai mult, s-a demonstrat că nivelurile ridicate de FFA in vitro induc la insulele normale aceleași modificări descrise în celulele β compensatoare ale obezității, cum ar fi hiperplazia celulelor β și secreția crescută de insulină la niveluri de glucoză substimulatoare (16, 26). În al treilea rând, s-a arătat că insulele șobolanilor obezi hiperinsulinemici au un conținut de TG extrem de ridicat în comparație cu colegii normali de litiere (20).
Animale.
Toate animalele aveau vârsta de 7-9 săptămâni la începutul experimentelor. Șobolani obezi, prediabetici Zucker diabetici grași (ZDF)fa/fa) au fost crescuți în laboratorul nostru de la ZDF/Drt-fa (F10) stoc achiziționat de la R. Peterson (Facultatea de Medicină a Universității din Indiana, Indianapolis, IN). Șobolanii masculi au prezentat fenotipul descris anterior (30).
Șobolanii masculi Wistar cumpărați de la laboratoarele de reproducere Charles River (Wilmington, MA) au fost folosiți ca controale slabe cu hrană gratuită și controale restricționate pentru dietă. Șobolanii cu restricție dietetică au fost perechi de șobolani Wistar hrăniți la șobolanii lipopenici care supraexprimă leptina descriși în paragraful următor; aceasta a dus la o reducere de 42% a aportului lor caloric total.
Animalele hiperleptinemice, lipopenice, erau șobolani Wistar normali care primiseră o perfuzie de adenovirus recombinant conținând ADNc de leptină (AdCMV-leptină). După cum sa raportat anterior (3), ARNm de leptină a apărut în ficat în asociere cu o creștere a nivelului plasmatic de leptină și o reducere a aportului de alimente și a greutății corporale (vezi Fig. 1). Un alt grup de șobolani Wistar a fost perfuzat cu adenovirus care conține cADN-ul unei proteine irelevante, β-galactozidaza bacteriană (AdCMV-βGal), ca control al infecției virale.
Studii de transfer genic.
Pentru a clona ADNc de leptină de șobolan și a măsura ARNm-ul său, ARN-ul total a fost preparat din 1 g de țesut adipos epididimal al șobolanilor prin extracție cu TRIzol, așa cum a recomandat producătorul. Oligo (dT) a fost utilizat pentru a prepara sinteza de ADNc pe prima catenă utilizând un kit de sinteză a ADNc (Clontech, Palo Alto, CA). După tratamentul cADN-ului cu prima catenă cu ribonuclează fără dezoxiribonuclează, produsul genei leptinei a fost amplificat prin reacția în lanț a polimerazei (PCR) cu grund de sens amonte 5'-GGAGGAATCCCTGCTCCAGC-3 'și grund antisens aval 5'-CTTCTCCTGAGGATACCTGG-3' pe secvența genei leptinei de șobolan (27). Atât pentru clonarea ADNc, cât și pentru măsurarea ARNm a leptinei, amplificarea a fost efectuată utilizând 1 ciclu la 94 ° C timp de 3 min, urmat de 35 de cicluri la 92 ° C timp de 45 s, la 53 ° C timp de 45 s și la 72 ° C timp de 1 min, apoi extinderea finală la 70 ° C timp de 10 min. De asemenea, am măsurat expresia β-actinei cu aceleași condiții de amplificare ca și pentru leptină și o pereche de oligonucleotide descrisă anterior (23).
Pentru a prepara virusul recombinant, un fragment PR de 640 bp conținând întreaga regiune de codificare a leptinei a fost ligat la pCR TM 2.1 (Invitrogen, San Diego, CA) conform protocolului producătorului. Analiza secvenței a confirmat că mai multe clone conțineau cpt ADN-ul leptinei intacte. ABamH I- șiXba Fragmentul de ADNc de leptină restricționat care a inclus 60 pb din regiunea netradusă 5 ′ și 76 pb din regiunea netradusă 3 ′ a fost ligat la pACCMVpLpA tratat în mod similar (10). Plasmida rezultată a fost cotransfectată cu pJM17 (23) în 293 celule prin coprecipitare de fosfat de calciu/ADN pentru a genera noul virus recombinant AdCMV-leptină prin utilizarea metodelor descrise anterior (1). ADN-ul virusului a fost izolat, iar prezența inserției genei leptinei a fost confirmată prin PCR utilizând primerii descriși mai sus și prin Southern blotting cu o oligonucleotidă (5′-GGATACCGACTGC GTGTGTGAAATGTCAT-3 ′) complementară ADNc-ului leptinei de șobolan. Stocurile de AdCMV-leptină au fost amplificate și purificate așa cum este descris (1) și depozitate la -70 ° C în soluție salină tamponată cu fosfat cu 0,2% albumină serică bovină (BSA) și 10% glicerol la 1-3 × 10 12 unități formatoare de plăci (pfu)/ml. Un virus care conține gena β-galactozidazei bacteriene sub controlul promotorului CMV, AdCMV-βGal, a fost preparat și utilizat așa cum s-a descris anterior (14).
Virusul a fost infuzat la șobolani Wistar masculi obținuți de la Charles River Laboratories (Wilmington, MA). Înainte de studiile de perfuzie cu adenovirus, toți șobolanii primeau ad libitum șobolan standard (Teklad F6 8664, Madison, WI) și aveau acces gratuit la apă. Tubulatura din polietilenă (PE-50, Becton-Dickinson, Franklin Lakes, NJ) a fost ancorată în artera carotidă stângă a șobolanilor Wistar în vârstă de 9 săptămâni de 250-300 g sub anestezie de sodiu pentobarbital (50 mg/kg, Abbott Laboratories North Chicago, IL) și exteriorizat printr-un tunel subcutanat. Tubulatura a fost umplută cu soluție salină heparinizată (1.000 U/dl) până când perfuzia de virus a început la 3 zile după operație. Înainte de perfuzie, probele de adenovirus au fost suspendate în soluție salină și filtrate printr-un filtru de 0,2 μm. Doi mililitri de AdCMV-leptină sau AdCMV-β-Gal conținând un total de 1 × 10 12 pfu au fost infuzați la animale anesteziate pe o perioadă de 1 oră. Animalele au fost studiate în cuști metabolice individuale (Nalgene, Rochester, NY), iar aportul de alimente și greutatea corporală au fost măsurate zilnic.
Măsurători plasmatice.
Începând cu o zi după perfuzia cu adenovirus, probele de sânge în post (1-3 PM) au fost colectate din vena cozii în tuburi capilare acoperite cu EDTA. Plasma a fost depozitată la -20 ° C până la momentul testării leptinei. Leptina plasmatică a fost testată folosind kitul de testare a leptinei Linco (Linco Research, St. Charles, MO). Insulina plasmatică a fost testată prin metode standard (37). Glucoza plasmatică a fost măsurată de Glucose Analyzer II (Beckman, Brea, CA).
Perfuzia pancreasului.
Pancreata a fost izolată și perfuzată prin metoda lui Grodsky și Fanska (12) așa cum a fost modificată anterior (17). Perfuzatul a fost format din tampon bicarbonat Krebs-Ringer conținând 4,5% Dextran T70, 5,6 mM glucoză, 1% BSA și 5 mM fiecare din piruvat de sodiu, glutamat de sodiu și fumarat de sodiu. Debitul a fost de 3,0 ml/min. După o perioadă de echilibrare de 20 de minute, pancreasul a fost perfuzat timp de 10 minute cu glucoză 5,6 mM. Apoi, concentrația de glucoză a fost crescută la 20 mM timp de 10 min. După o „odihnă” de 10 minute, timp în care nivelul de glucoză a fost readus la valoarea inițială, arginina a fost perfuzată la o concentrație de 8 mM pentru un total de 10 min. Probele au fost colectate la intervale de 1 min pentru determinarea concentrației de insulină. Au fost plasate în tuburi răcite conținând 0,3 ml NaCl 0,15 M, Na2EDTA 0,05 M și benzamidă 0,3 M și au fost congelate până la momentul testării.
Conținutul de TG al ficatului, mușchiului scheletic, pancreasului și insulelor.
Țesuturile au fost disecate și plasate în azot lichid. Aproximativ 100 mg de țesuturi au fost plasate în 4 ml tampon de omogenizare conținând 18 mM de tris (hidroximetil) aminometan ⋅ HCI (pH = 7,5), 300 mM de d-manitol și 5 mM de etilen glicol-bis (β-aminoetil eter )))-N,N,N′,NAcid tetraacetic și au fost omogenizați folosind un poltron portabil (Kontes Glass, Vineland, NJ) timp de 10 secunde. Lipidele au fost extrase prin metoda lui Folch și colab. (9). TG total au fost analizate prin metoda lui Danno și colab. (6).
analize statistice.
Toate datele sunt exprimate ca mijloace ± SE. Diferența statistică a fost analizată prin nepereche t-Test.P 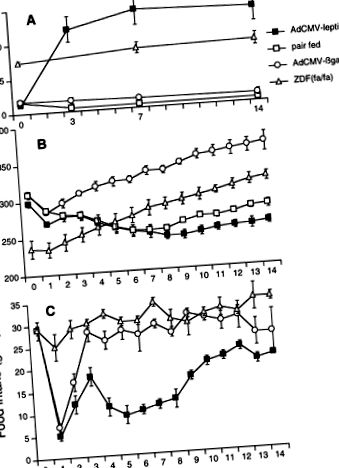
FIG. 1.Comparația nivelurilor plasmatice de leptină (A), greutate corporala (B) și consumul de alimente (C) la șobolani infuzați cu un adenovirus recombinant care conține ADNc de leptină (AdCMV-leptină), pereche normală de șobolani hrăniți la primii șobolani normali cu hrană liberă infuzați cu un adenovirus care conține ADNc de β-galactozidază (AdCMV-βgal) și diabet zaharat Zucker șobolani grași [ZDF (fa/fa)]].
Nivelul glicemiei a scăzut sub 2,6 mM și a rămas sub normal pe parcursul celor 14 zile (Fig. 2A). Nivelurile de insulină plasmatică în jeun au fost în medie de numai 33,6 ± 5,0 pM la 14 zile după perfuzie virală, comparativ cu 79,3 ± 5,7 și 95,7 ± 3,6 pM la controalele tratate cu βGal hrănite în pereche și respectiv cu hrană liberă (Fig.2)B).
FIG. 2.Comparația insulinei plasmatice (A) și glucoză (B) la șobolani infuzați cu AdCMV-leptină, perechi de șobolani normali hrăniți la primii șobolani normali infuzați cu AdCMV-βgal și ZDF (fa/fa) șobolani.
Conținutul lipidic tisular în diferitele grupuri.
La două săptămâni după perfuzia cu AdCMV-leptină, conținutul de țesut al TG a fost măsurat în ficat, mușchi scheletic, pancreas întreg și insulițe de șobolani hiperleptinemici, vârstnici, șobolani martor hrăniți cu perechi și hrăniri libere și șobolani obezi. Conținutul de TG este prezentat în Tabelul 1, exprimat atât pe gram de greutate umedă, cât și ca procent din țesuturile celor trei grupuri martor. La șobolanii hiperleptinemici, conținutul de TG al ficatului a fost în medie de 13,3% din cel al șobolanilor cu infuzie βGal cu hrană liberă și a fost de numai 6,4% din cel al șobolanilor obezi; conținutul de grăsime al mușchilor scheletici a fost de 8% din cel al controalelor cu infuzie βGal cu hrană liberă. În pancreasul întreg, conținutul de TG al hiperleptinemiei a fost de 5,3% din cel al controalelor AdCMV-βGal și de 12,9% din cel al controalelor hrănite în perechi.
Tabelul 1. Conținutul de TG în mușchi, ficat și pancreas la șobolani infuzați cu AdCMV-leptină, comparativ cu 3 grupuri de control
Valorile sunt medii ± SE. Nr. de experimente sunt între paranteze. AdCMV-leptină și AdCMV-βGal, un adenovirus care conține ADNc de leptină și, respectiv, β-galactozidază; pereche hrănită, șobolani normali pereche hrănită la șobolani infuzați cu leptină AdCMV; ZDF ( fa/fa), agățați șobolanii grași diabetici Zucker. Semnificativ (P * vs. pereche hrănită;
‡ vs. ZDF ( fa/fa).
La insulele izolate de șobolani hiperleptinemici, conținutul de TG pe insulă a fost sub sensibilitatea testului așa cum este utilizat. Insulele șobolanilor cu hrană liberă AdCMV-βGal conțineau 28 ng/insulă de TG, cele ale șobolanilor hrăniți în perechi conțineau 14 ng/insulă, în timp ce insulele șobolanilor obezi aveau o medie de 990 ng/insulă.
Corelații între conținutul de TG al pancreasului și produsul insulinei plasmatice și al glucozei plasmatice și al producției de insulină de către pancreasul izolat.
Pentru a determina relația dintre funcția celulei β și conținutul de grăsime din insulă, am examinat corelațiile dintre conținutul de grăsime pancreatică și producția de insulină de către pancreasul perfuzat izolat din toate grupurile. Perfuzatul consta fie din 5,6 mM glucoză, 20 mM glucoză, fie 8 mM arginină plus 5,6 mM glucoză. Am măsurat, de asemenea, corelația dintre grăsimea pancreatică și plasma [insulină] × plasmă [glucoză], care distinge între hipoinsulinemie care are ca rezultat creșterea concentrațiilor de glucoză din sânge și hipoinsulinemie asociată cu creșterea eficacității insulinei.
S-a observat o relație foarte semnificativă între conținutul de plasmă [insulină] × [glucoză] și TG din țesuturi (r = 0,93,P = 0,0001). O corelație similară a fost observată între insulina plasmatică și conținutul de TG tisular (r = 0,93,P = 0,0001). Relațiile dintre conținutul de TG al celor trei țesuturi și [insulină] × [glucoză] sunt prezentate în Fig. 3. Corelarea cu conținutul de TG al insulelor izolate nu este prezentată, deoarece insulele nu puteau fi cântărite cu precizie și variate ca mărime cu un factor de 4.
FIG. 3.Corelații între conținutul de trigliceride (TG) al tuturor țesuturilor examinate (mușchi scheletic, ficat și pancreas) la șobolani infuzați cu AdCMV-leptină, perechi de șobolani hrăniți la primii șobolani normali infuzați cu AdCMV-βgal și ZDF (fa/fa) șobolani și produsul [insulină] × [glucoză]. Corelația doar cu insulina plasmatică a dat o identicăr valoare (nu este afișată).
În studiile privind pancreasul perfuzat, producția de insulină a fost cea mai scăzută în grupul hiperleptinemic și a crescut progresiv pe măsură ce conținutul de TG al pancreasului a crescut. Astfel, în grupul hiperleptinemic, secreția de insulină la 5,6 mM glucoză a fost scăzută, dar nu a fost semnificativ diferită de cea a martorilor hrăniți în perechi, în timp ce răspunsurile atât la glucoză cât și la arginină au fost complet absente (Fig. 4). La cealaltă extremă a TG tisulară, producția de insulină a fost cea mai mare în grupul obez ZDF și intermediară în grupurile de control infuzate cu AdCMV-βGal și alimentate în perechi. Pancreata de la șobolanii obezi ZDF a avut cel mai mare conținut de grăsimi și a prezentat cea mai mare rată de secreție de insulină bazală și cele mai rapide răspunsuri la glucoză și arginină în termeni absoluți (Fig. 4). Coeficienții de corelație a conținutului de TG între cei trei parametri ai funcției celulelor β (bazală, stimulată de glucoză și secreția de insulină stimulată de arginină) au variat de la 0,89 la 0,99.
FIG. 4.Comparația conținutului de TG al pancreasului (A) și producția de insulină prin pancreas perfuzat (B) izolate de șobolani hiperleptinemici, perechi normale de șobolani Wistar hrăniți la primii șobolani infundați cu AdCMV-βgal și ZDF (fa/fa) șobolani.
Scopul acestui studiu a fost de a determina dacă conținutul de grăsime din țesuturile țintă ale insulinei și din pancreas este corelat atât cu eficacitatea insulinei, cât și cu rata de secreție a acesteia. Dacă da, ar fi în concordanță cu noțiunea că răspunsurile celulelor β sunt adaptate nevoilor de insulină de către un derivat al TG, cum ar fi FFA. Acest lucru ar facilita menținerea euglicemiei în ciuda schimbării compoziției corpului asociată cu obezitatea. Cu toate acestea, ar trebui subliniat faptul că corelațiile nu pot dovedi cauza și efectul și că interpretările alternative ale acestor corelații sunt la fel de posibile. De exemplu, hiperinsulinemia primară ar putea crește lipogeneza și poate determina creșterea TG tisulară, care la rândul său ar putea duce la rezistență la insulină (24, 25).
Am angajat atât șobolani obezi ZDF, cât și șobolani Wistar slabi. Disponibilitatea unui animal unic „fără grăsimi”, șobolanul hiperleptinemic, un model nou de lipopenie extremă care este antiteza obezității, a făcut posibilă examinarea acestor corelații pe cel mai larg spectru posibil de conținut de TG, variind de la lipopenie extremă la obezitate severă. În experimentele de perfuzie acută, leptina nu a avut niciun efect asupra producției de insulină (date neprezentate), dar în studiile cronice ale insulelor cultivate, leptina a abolit răspunsurile insulinei atât la secreția de insulină stimulată de glucoză, cât și de arginină, în timp ce epuiza insula TG; FFA a restabilit răspunsul la insulină aproape imediat (19).
NOTE AUTORULUI
Adresa pentru solicitări de reimprimare: R. H. Unger, Centrul pentru Cercetarea Diabetului, Univ. din Texas Southwestern Medical Center, 5323 Harry Hines Blvd., Dallas, TX 75235–8854.
- Hrănirea cu grăsimi trans are ca rezultat o alanină aminotransferază serică mai mare și o rezistență crescută la insulină
- Caracteristica stării tiroidiene la tinerii supraponderali și obezi cu rezistență la insulină
- Tratamentul EMS și rezistenței la insulină (IR) în PPID ECIR Group, Inc.
- Trigliceridele induc rezistența la leptină la nivelul barierei hematoencefalice
- Creșterea producției de propionat în colon este asociată cu greutatea corporală redusă a apetitului și îmbunătățirea sensibilității la insulină
