Meryl C. Woodall
1 Centrul de Medicină Translațională, Școala de Medicină Lewis Katz, Universitatea Temple, Philadelphia, PA, SUA
Benjamin P. Woodall
1 Centrul de Medicină Translațională, Școala de Medicină Lewis Katz, Universitatea Temple, Philadelphia, PA, SUA
Erhe Gao
1 Centrul de Medicină Translațională, Școala de Medicină Lewis Katz, Universitatea Temple, Philadelphia, PA, SUA
Ancai Yuan
1 Centrul de Medicină Translațională, Școala de Medicină Lewis Katz, Universitatea Temple, Philadelphia, PA, SUA
2 Departamentul de Cardiologie, Spitalul Ren Ji, Facultatea de Medicină, Universitatea Shanghai Jiao Tong, Shanghai, China.
Walter J. Koch
1 Centrul de Medicină Translațională, Școala de Medicină Lewis Katz, Universitatea Temple, Philadelphia, PA, SUA
Date asociate
Abstract
Raţional
Receptorul kinazei 2 cuplate cu proteina G (GRK2) este o moleculă importantă reglată în sus după leziuni miocardice și în timpul insuficienței cardiace. Pierderea GRK2 specifică miocitelor înainte și după leziunea ischemică miocardică îmbunătățește funcția cardiacă și remodelarea. Fibroblastul cardiac joacă un rol important în repararea și remodelarea evenimentelor care urmează ischemiei cardiace; importanța GRK2 în aceste evenimente nu a fost investigată.
Obiectiv
Scopul acestui studiu este de a elucida implicațiile in vivo ale ștergerii GRK2 în fibroblastul cardiac după leziuni de ischemie/reperfuzie (I/R).
Metode și rezultate
Demonstrăm, folosind șoareci knock-out GRK2 inducibili cu tamoxifen, specifici fibroblastelor, că pierderea GRK2 conferă un avantaj protector față de șoarecii martori după leziunea miocardică I/R. Șoarecii knockout Fibroblast GRK2 au prezentat o dimensiune scăzută a infarctului și funcție cardiacă păstrată 24 de ore după I/R, după cum s-a demonstrat prin creșterea fracțiunii de ejecție (58,1 ± 1,8% față de 48,7 ± 1,2% la martori, p Cuvinte cheie: Ischemie miocardică/leziuni de reperfuzie, receptor kinază cuplată cu proteina G 2, fibroblast cardiac, fibroză, inflamație
INTRODUCERE
Leziunea ischemie/reperfuzie (I/R) activează un răspuns inflamator „steril” în care neutrofilele sunt recrutate în zona ischemică de către miocitele necrotice și speciile reactive de oxigen (ROS). 7 Se consideră că infiltrarea excesivă de neutrofile în locul infarctat dăunează supraviețuirii miocitelor, întrucât neutrofilele secretă și ROS, exacerbând în continuare distrugerea celulelor și a țesuturilor. 8 Înțelegerea inflamației și remodelarea după leziuni I/R este importantă pentru dezvoltarea de noi terapii; studii multiple au demonstrat că inhibarea extravazării neutrofilelor reduce deteriorarea țesuturilor și scade dimensiunea infarctului. 9-11 Suntem interesați de semnalele cardiace și de comunicarea celulară dintre miocite și fibroblaste care pot regla sau modifica leziunile tisulare după leziunea I/R.
În timp ce reglarea GPCR în miocite în timpul leziunii ischemice a fost studiată pe larg, semnalizarea fibroblastelor GPCR în timpul leziunii I/R și focalizarea acestui studiu, GPCR kinaza 2 (GRK2), nu a fost bine caracterizată. Rolul principal al GRK2 este de a fosforila GPCR-urile activate de agoniști și de a le viza pentru internalizarea mediată de β-arestină; în inimă, GRK2 este reglat în miocit după rănire și activitatea sa îmbunătățită vizează receptorul β-adrenergic (βAR) pentru a modula contractilitatea. 12-13 Decenii de cercetare au descoperit efectele dăunătoare ale activității crescute a GRK2 în bolile de inimă și au furnizat dovezi cuprinzătoare că pierderea expresiei miocitelor GRK2 sau inhibarea acesteia înainte sau după insulta cardiacă este benefică pentru contractilitatea miocardică și remodelarea cardiacă. 14-16 Studii mai recente s-au extins și asupra versatilității GRK2 prin delimitarea rolurilor necanonice în regulamentul eNOS 17.18, funcția mitocondrială 19.20 și semnalizarea insulinei. 21
În prezent, se știe puțin despre funcția GRK2 în fibroblastul cardiac. În acest studiu am căutat să examinăm dacă pierderea fibroblastului GRK2 ar fi avantajoasă sau dăunătoare funcției cardiace după leziuni ischemice acute in vivo. Folosind șoareci inductibili și condiționați GRK2 knockout (KO), am supus șoareci GRK2 KO specifici fibroblastului la leziuni miocardice I/R și am investigat efectele legate de funcția inimii, fibroză și inflamație. Rezultatele noastre arată clar că, într-o situație acută, pierderea fibroblastului GRK2 este benefică pentru funcția cardiacă și remodelare și că acest lucru poate fi legat de diferențele în recrutarea celulelor inflamatorii în primele ore următoare reperfuziei. De asemenea, am efectuat experimente in vitro pe fibroblaste cardiace neonatale și șoareci adulți proaspăt izolați pentru a obține o perspectivă asupra modului în care fibroblastul poate influența supraviețuirea miocitelor și inflamația cardiacă in vivo.
METODE
Animale experimentale
Pentru a obține șoareci inductibili, specifici fibroblastului GRK2 KO, șoarecii Colagen1α2-CreER (T) 22 (Jackson Labs Stock # 029235) au fost încrucișați cu șoareci GRK2 fl/fl 23 (Jackson Labs Stock # 012458). Puii au fost încrucișați înapoi pentru a genera șoareci Collagen1α2-CreER (T)/GRK2 fl/fl (denumiți GRK2 fKO). Șoarecii GR/2 fl/fl au fost folosiți ca martori de tip sălbatic (WT). Tamoxifenul (Sigma T5648) a fost injectat intraperitoneal (IP) zilnic timp de 10 zile la 40 mg/kg/zi. Toate studiile pe animale au fost realizate cu aprobarea Comitetului de îngrijire și utilizare a animalelor de la Temple University.
Izolarea fibroblastelor și miocitelor cardiace adulte de șoarece
Inimile au fost îndepărtate de la șoareci cu vârsta> 2-3 luni și procesate așa cum s-a descris anterior. 24
Izolarea celulelor măduvei osoase și prepararea lizatului
Femurele au fost îndepărtate de la șoareci cu vârsta> 2-3 luni. Conținutul a fost spălat folosind soluția de sare tamponată a lui Hank (Corning 21-023-CV), o seringă și un ac de calibru 27. Celulele măduvei osoase au fost centrifugate și spălate cu 1X PBS. Celulele au fost resuspendate în tampon RIPA suplimentat cu inhibitori de protează, sonicate și centrifugate pentru a îndepărta resturile celulare.
Izolarea mușchiului neted vascular și a preparatului de lizat
Aortele toracice au fost izolate de la șoareci cu vârsta> 2-3 luni. După spălare în 1X PBS, aortelor li s-a răspuns în tampon RIPA suplimentat cu inhibitori de protează, sonicați și centrifugați pentru a îndepărta resturile celulare.
Izolarea fibroblastelor cardiace neonatale de șobolan
Fibroblastele cardiace neonatale de șobolan sunt izolate ca un produs secundar al izolării miocitelor cardiace cardiace neonatale de șobolan, efectuată așa cum s-a descris anterior 17 .
Imunoblotarea
Anticorpii GRK2 și GAPDH provin de la Santa Cruz. Anticorpii fosfo-AKT și total AKT provin de la semnalizarea celulară.
Model in vivo al leziunii ischemice/reperfuzionale
Leziunea de ischemie/reperfuzie a fost efectuată așa cum s-a descris anterior. 25 Dimensiunea infarctului a fost măsurată așa cum s-a descris anterior. 26
Analiza ecocardiografică transtoracică
Ecocardiografia bidimensională transtoracică a fost realizată orbită așa cum s-a descris. 25
Analiza hemodinamică terminală a funcției cardiace
Analiza hemodinamică a fost efectuată orbită așa cum s-a descris anterior. 25
Măsurarea apoptozei miocardice
Apoptoza miocardică a fost evaluată prin colorarea TUNEL. 18
Evaluarea fibrozei miocardice
Nivelurile de colagen au fost măsurate folosind trusa de colorare Trichrome Masson (Sigma HT15) și kitul de testare a hidroxiprolinei (Sigma MAK008) fără modificări.
Măsurarea nivelurilor AMPc
Fibroblastele cardiace neonatale de șobolan au fost tratate cu izoproterenol 10 μM timp de 15 minute. nivelurile de AMPc au fost măsurate utilizând kitul de analiză AMP XP ciclic (semnalizare celulară 4339) fără modificări.
Imunofluorescența
Inimile au fost recoltate 72 de ore după reperfuzie, fixate peste noapte în paraformaldehidă 4%, încorporate în parafină și tăiate pe axa lungă în secțiuni de 6um. După deparafinare, rehidratare și recuperare a antigenului utilizând soluția de demascare a vectorului antigen (Vector Labs H3300), secțiunile au fost blocate în 10% FBS/1X PBS. Anticorpul primar (α-SMA, Sigma A5228) a fost incubat cu secțiuni peste noapte la 4 ° C. Anticorpul secundar (Life Technologies A21463) a fost aplicat timp de 1 oră la temperatura camerei. Secțiunile au fost tratate cu suport de montare DAPI și acoperite. Intensitatea fluorescenței a fost măsurată folosind ImageJ. Pentru colorarea fibroblastelor cardiace neonatale de șobolan, celulele au fost tratate cu metanol timp de 15 minute la -20 °, spălate și blocate timp de 1 oră la temperatura camerei în 5% BSA/PBS. Anticorpul P65 (Cell Signaling 6956) a fost incubat peste noapte la 4 ° C și anticorpul secundar (Life Technologies) a fost aplicat timp de 1 oră la temperatura camerei. Secțiunile au fost tratate cu suport de montare DAPI și acoperite. Celulele au fost numărate folosind imaginea J pe cel puțin cinci câmpuri per grup. Toate imaginile de imunofluorescență au fost realizate cu un microscop Nikon Ti.
Colorarea mieloperoxidazei (MPO)
Șoarecii au fost eutanasiați după 6 și 24 de ore de reperfuzie, iar inimile au fost fixate în paraformaldehidă 4%. Inimile au fost încorporate în parafină și tăiate în secțiuni groase de 5 μm. Imunohistochimia a fost efectuată pe secțiuni, inclusiv recuperarea antigenului cu soluție de demascare a antigenului vector. Anticorpul primar MPO și anticorpul secundar au fost obținute de la Santa Cruz (sc16129, respectiv sc2354). Imagini ale zonei de infarct ale peretelui LV au fost preluate din cel puțin două câmpuri alese aleatoriu pe un Nikon DS-Ri1 și cuantificate într-o manieră oarbă folosind ImageJ.
Microarray de citokine
Fibroblastele cardiace adulte de șoarece au fost izolate așa cum s-a descris mai sus. Celulele au fost supuse tamponului de ischemie in vitro 27 și supernatantul a fost recoltat pentru a fi utilizat cu panoul A de citokine Proteome Profiler Mouse Cytokine Array (R&D ARY006) cu o singură modificare: IRDye 800CW Streptavidin (Rockland S000-31) a fost utilizat.
Experiment media condiționat
Fibroblastele cardiace neonatale au fost tratate cu LacZ sau shGRK2 care conțin adenovirus. După 24 de ore fibroblastele au fost înfometate cu ser peste noapte, tratate timp de 30 de minute cu tampon de ischemie in vitro și apoi refuzate în DMEM 0,1% timp de 3 ore. Supernatantul a fost colectat și plasat pe miocite cardiace neonatale timp de 10 minute. Fibroblastele au fost colectate pentru a asigura pierderea GRK2 și miocitele au fost colectate pentru lizatul celulei întregi.
Tampon de reperfuzie pentru ischemie in vitro
Acest tampon simulează mediul extracelular al unui mediu ischemic, deoarece este deficit de glucoză, hiperkalemic și bogat în acid/lactat. Este compus din 137mM NaCl, 3,8mM KCl, 0,49mM MgCl2, 0,9mM CaCl2, 4,0mM Hepes suplimentate cu 10mM 2-deoxiglucoză, 20mM lactat de sodiu, 1mM sodiu ditionită și 12mM KCL, pH 6,5.
analize statistice
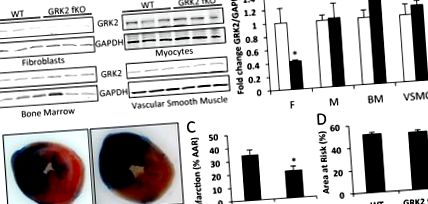
Datele sunt exprimate ca medie ± SE. Semnificația statistică a fost determinată de testul t nepereche pe experimente care compară două grupuri sau testul ANOVA și Tukey pentru experimentele care implică patru comparații folosind vassarstats.net. Valorile P Figura 1a). Eliminarea GRK2 a fost specifică pentru fibroblaste, deoarece nivelurile de proteine au fost menținute în miocite, celulele măduvei osoase și celulele musculare netede vasculare după tratamentul cu tamoxifen în ambele grupuri (Figura 1a). Această constatare se corelează cu rapoartele publicate anterior folosind acest model pentru alte produse genetice. 24,28 Putem deduce interferențe neglijabile din deranjarea fibrocitelor circulante. În timp ce acest tip de celulă are calități fibroblaste, fibrocitele sunt derivate din monocite, iar nivelurile de GRK2 sunt menținute în celulele măduvei osoase. Mărimea infarctului ventricular stâng (LV) după 30 de minute de ocluzie a arterelor coronare descendente anterioare stângi și 24 de ore de reperfuzie a fost măsurată la șoarecii GRK2 fKO și s-au găsit diferențe semnificative comparativ cu șoarecii martor (Figura 1). La colegii WT, dimensiunea infarctului LV a fost de 34,17 ± 3,98% din zona cu risc (Figura 1b, c). Cu toate acestea, ablația specifică fibroblastului GRK2 a cauzat o dimensiune a infarctului scăzută de 20,67 ± 3,03%. Zona VS cu risc a fost similară în ambele grupuri, indicând aceeași cantitate de traume ischemice (Figura 1d). Aceste rezultate stabilesc că pierderea fibroblastului GRK2 în timpul leziunii ischemice acute conferă un avantaj protector țesutului miocardic reperfuzat.
A) Fotografii reprezentative ale secțiunilor colorate cu TUNEL și actină α-sarcomerică (αSA) din zona de frontieră a inimilor 6 ore post-I/R WT și GRK2 fKO, inclusiv imagine 40X care prezintă cardiomiocite TUNEL și αSA + (săgeți albe). Bara de scalare, 100 μm. actină α-sarcomerică (verde), cardiomiocite; TUNEL (roșu), nuclee apoptotice; DAPI (albastru), nuclee totale. B) Cuantificarea TUNEL + cardiomiocitelor reprezentată ca procent de celule TUNEL și αSA + în WT și GRK2 fKO. * P Figura 3c, d). Fibroblastele au fost tratate cu adenovirus care conține un shRNA pentru GRK2 sau un adenovirus de control LacZ (Figura 3c panoul superior), expus la un tampon Kreb in vitro și reperfuzat cu DMEM timp de 3 ore. Supernatantul a fost colectat, plasat pe miocite și a fost măsurată semnalizarea AKT (Figura 3C panoul inferior). Mediile condiționate din adenovirusul LacZ și fibroblastele tratate I/R in vitro au crescut AKT fosforilat în miocite comparativ cu mediile din fibroblastele tratate numai cu adenovirus LacZ. Knockdown-ul GRK2 în fibroblastele cardiace a potențat această creștere a AKT fosforilat în miocite după tratamentul cu medii condiționate fibroblaste I/R in vitro, indicând faptul că pierderea in vitro a GRK2 în fibroblaste este capabilă să modifice secretomul fibroblastului pentru a spori semnalizarea supraviețuirii în miocite (Figura 3d ).
Ablația GRK2 în fibroblaste inhibă fibroza miocardică indusă de I/R și reglarea în sus a genei fibrotice
A) Imagini reprezentative ale lui Masson Trichrome și cuantificarea zonei infarctului 72 de ore după I/R. Cuantificare exprimată ca procent de fibroză din suprafața totală. Bara de scalare, 50μm *** P Figura 5a). Interesant, am constatat că atât șoarecii WT, cât și șoarecii GRK2 fKO au exprimat cantități egale de proteină actină a mușchiului neted α, ambele grupuri demonstrând o creștere de 2,64 ori (Figura 5b). Am găsit, de asemenea, creșteri similare ale expresiei mARN-ului α-SMA atât la șoarecii WT, cât și la șoarecii GRK2 fKO (Figura 5c).
S-a documentat că β2-AR sunt antiinflamatorii. În cadrul leziunii pulmonare acute murine, agoniștii β2-AR au redus nivelurile de neutrofile și TNFα infiltrante în supernatantul macrofagelor izolate tratate cu LPS. 37 În plus, infiltrarea neutrofilelor în celulele endoteliale ale venulei de șobolan după tratamentul cu substanța P a fost inhibată folosind agonistul β2-AR, formoterolul. 38 Fibroblastele cardiace la șoareci și oameni sunt predominant populate cu subtipul β2-AR 39, 40 și o țintă majoră a GRK2. Pierderea GRK2 poate menține sau chiar îmbunătăți semnalizarea antiinflamatoare mediată de β2-AR în contextul leziunii ischemice, care ar putea avea semnificație translațională la pacienții cardiaci.
În plus, există dovezi că AMPc inhibă producția de TNFa prin β2-AR. 41 După tratamentul cu LPS, rolipramul inhibitor selectiv de cAMP-PDE IV a inhibat producția de TNFα. 42 În schimb, tratarea macrofagelor murine cu agenți care ridică AMPc intracelular suprimat expresia genei inflamatorii induse de LPS, inclusiv TNFα. 43 Mecanic, AMPc ridicat duce la PKA activat, care fosforilează și facilitează degradarea p105, precursorul p50. 44 Aceste date sugerează un alt mecanism potențial pentru modul în care scăderea GRK2 poate duce la niveluri de TNFα atenuate; prin menținerea nivelurilor de AMPc formate prin semnalizarea β2-AR conservată sau îmbunătățită. În conformitate cu acest raționament, vedem că pierderea GRK2 în fibroblastele cardiace a dus la niveluri potențate de AMPc în comparație cu fibroblastele WT după tratamentul cu izoproterenol.
Rezultatele noastre sugerând acțiuni pro-inflamatorii ale conflictului GRK2 cu alte rapoarte care concluzionează că GRK2 este antiinflamator. Knockdown GRK2 specific celulei mieloide a crescut leziunile tisulare după injecția LPS prin îmbunătățirea semnalizării NFκB1p105-ERK 45. Limfocitele cu niveluri reduse de GRK2 prezintă chemotaxie crescută la CCL3, CCL4 și CCL5 46. Cu toate acestea, în timp ce șoarecii hemizigoti GRK2 afectați de encefalomielită experimentală autoimună (EAE) au un debut mai rapid al bolii decât omologii EAE de tip sălbatic, șoarecii GRK2 +/- nu suferă de recăderi ca șoarecii de tip sălbatic. Lipsa recidivelor a fost corelată cu infiltratele inflamatorii ale SNC atenuate 47. În plus, nivelurile ridicate de GRK2 se corelează direct cu severitatea bolii Alzheimer la pacienții umani 48. Aceste rapoarte contradictorii asupra rolului inflamator al GRK2 indică faptul că nu există un răspuns clar și concluziile pot depinde de tipul celular și de modelul bolii.
Un alt aspect interesant al descoperirilor noastre este că, în ciuda nivelurilor reduse de fibroză și expresie genică fibrotică văzute în grupul GRK2 fKO, activarea miofibroblastelor și expresia α-SMA par să fie similare atât la șoarecii WT cât și la cei fKO. Evenimentele care guvernează transformarea miofibroblastelor și genele fibrotice sunt multi-factoriale, în ceea ce privește GRK2, axa AMPc este o cale de semnalizare importantă pentru reglarea acestor evenimente. Activarea adenilat ciclazei după activarea GPCR duce la formarea AMPc. cAMP poate modula răspunsurile prin două platforme de semnalizare, PKA și Epac. Swaney și colab. Au demonstrat că atât activarea AMPc, cât și activarea Epac de către agenți exogeni pot blinda sinteza colagenului, expresia α-SMA și transformarea miofibroblastului în fibroblastele cardiace de șobolan, indicând roluri paralele. 56 Cu toate acestea, AMPc și Epac au efecte opuse asupra migrației fibroblastelor. 57 Aceste contraste se datorează cel mai probabil diferențelor dintre protocoale (ex vivo versus in vivo), specii (șobolan versus șoarece) și modelul de leziune (I/R versus agenți fibrotici exogeni), dar neregularea acestei axe de semnalizare dublă după I/R ar putea explica aceste diferențe.
Din punct de vedere terapeutic, rezultatele noastre sunt semnificative deoarece întăresc ideea că inhibarea GRK2 atât în miocite cât și în fibroblaste este benefică pentru menținerea rezervei inotrope. Există un vast corp de literatură care demonstrează efectele protectoare ale ablației GRK2 în miocitul cardiac după ischemie, dar date limitate care arată beneficiile deleției GRK2 în fibroblastul cardiac. Scopul acestui studiu a fost investigarea efectelor acute și cronice ale ablației GRK2 în fibroblastul cardiac; am văzut că eliminarea fibroblastelor GRK2 previne moartea miocitelor și inflamația excesivă și conferă beneficii pe termen lung funcției cardiace. O investigație detaliată a rolului GRK2 în timpul inflamației post-ischemice în inimă este importantă pentru analize viitoare. Cu toate acestea, descoperirile noastre actuale adaugă profunzime diferitelor roluri benefice atribuite anterior pierderii GRK2, prin căi clasice sau neclasice.
Noutate și semnificație
Ce se știe?
Receptorul kinazei 2 cuplate cu proteina G (GRK2) este GRK major în inimă și este reglat în sus după leziuni cardiace și în timpul insuficienței cardiace.
- Un nou analog GIP, ZP4165, îmbunătățește pierderea în greutate corporală indusă de peptida-1 asemănătoare glucagonului și
- Extractul de usturoi îmbătrânit îmbunătățește îmbunătățirea mediată de efort a parametrilor metabolici în grăsimi bogate
- Dimensiune cardiacă Articol despre mărimea cardiacă de The Free Dictionary
- Un startup chinez a creat o cameră care îți îmbunătățește fața - Business Insider
- 039; Aceasta; # 039; cu Numit Pranayama; # 039 Indienii Respinge Scientific American; # 039; s; # 039; Cardiac