Subiecte
Abstract
Nanoparticulele de siliciu cristalin (Si) prezintă un obiect extrem de promițător pentru bioimagistica bazat pe fotoluminescență (PL) în regiunile spectrale vizibile și în infraroșu apropiat, dar emisia lor eficientă de PL în suspensie apoasă este de obicei observată după proceduri de chimie umedă care duc la probleme de toxicitate reziduală. Aici, introducem puncte cuantice (QD) bazate pe Si sintetizate cu laser ultra-pur, care sunt dispersabile în apă și prezintă exciton PL luminos în fereastra transparenței țesutului relativ de aproape 800 nm. Pe baza ablației cu laser a obiectivelor cristaline de Si în heliu gazos, urmată de dispersia asistată cu ultrasunete a filmelor depuse în ser fiziologic, metoda propusă evită orice subprodus toxic în timpul sintezei. Demonstrăm un contrast eficient al QD-urilor de Si în celulele vii urmărind excitonul PL. Arătăm, de asemenea, că QD-urile preparate nu provoacă efecte de citoxicitate în timp ce pătrund în celule și se acumulează eficient în apropierea membranei celulare și în citoplasmă. Combinate cu posibilitatea de a activa canale terapeutice paralele, nanostructurile de Si sintetizate cu laser ultrapur prezintă un obiect unic pentru aplicații teranostice ale cancerului.
Introducere
Aici, raportăm o soluție a problemei de toxicitate secundară a dispersabilei în apă cu luminiscență puternică da-QD-uri bazate pe utilizarea unei sinteze asistate de laser. Formată prin ablația cu laser dintr-un solid c-Si țintă în gaz El și crescute în mediu laser-plasmă, da nanoclustrii experimentează cristalizarea aproape perfectă, urmată de pasivarea suprafeței de către oxigen în timpul expunerii lor la aer (pasivarea oxidului). După dispersia în soluții apoase, oxidul pasivat da QD prezintă un PL puternic pe bază de exciton cu QY de câteva procente fără proceduri suplimentare de chimie umedă. QD-urile nu prezintă niciun semn de toxicitate, demonstrează biodegradabilitatea și absorbția celulară excelentă, ceea ce le face candidați ideali pentru aplicații de bioimagistică.
Rezultate si discutii
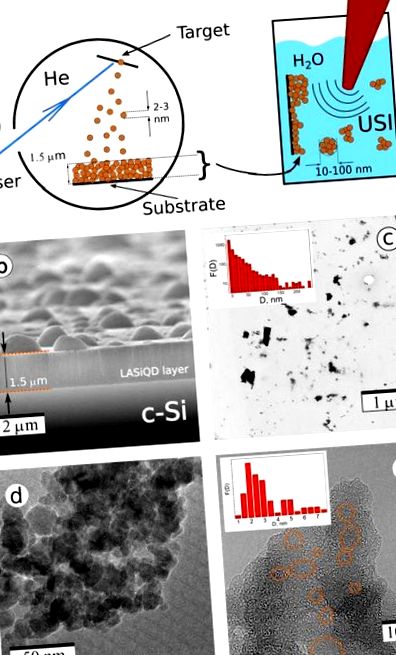
(A) Sinteza laser-ablativă a nanostructurilor de Si. (A) Scheme ale sintezei laser în doi pași: Ablația laser a c-Si țintă în rezidual El gazul duce la depunerea unui LA nanostructurat-da film (panoul din stânga); filmul este apoi tratat prin iradiere cu ultrasunete într-o soluție fiziologică apoasă care are ca rezultat îndepărtarea da nanocristale și formarea de NP dispersate în apă; (b) Imagine cu microscopie electronică de scanare (SEM) a ablat cu laser da-film nanostructurat pe bază depus pe c-Si substrat; Microscopie electronică cu transmisie (TEM)c) și imagini TEM de înaltă rezoluție (d, e) din LA-da NP produse prin frezarea cu ultrasunete a filmelor nanostructurate ablate cu laser. Elipsele portocalii descriu da nanocristale.
Figura 1c prezintă o imagine tipică de microscopie electronică cu transmisie (TEM) a da nanoparticule (NP) obținute după etapa de sonificare și distribuția corelată a dimensiunilor NP înainte de orice filtrare a mărimii (inserție). Se poate observa că, în ciuda prezenței aglomeratelor mari, majoritatea ablatelor cu laser da NP (LA-da NP) au un diametru mai mic de 100 nm, ceea ce le face potrivite pentru aplicații biomedicale. Mai mult, LA mare-da PN-urile prezintă agregări de nanoparticule mici (Fig. 1d) și pot fi dezintegrate în timpul depozitării lor în medii apoase (Fig. 2c). Structura fină a LA tipic-da PN-urile pot fi văzute în imaginea HRTEM din Fig. 1e. Este vizibil că aceste LA-da NP sunt compuse din boabe cristaline distribuite aleatoriu (notate prin cercuri portocalii) încorporate într-o matrice poroasă. O astfel de matrice este compusă în cea mai mare parte din SiOx amorf, deoarece s-a evidențiat mai devreme 33,37,38. După cum rezultă din datele FTIR (a se vedea Fig. S2 în Informații suplimentare), compoziția stratului superior este apropiată de dioxidul de siliciu, adică. X = 1,95 ± 0,05, dar straturile mai profunde evidențiază prezența unei fracțiuni din faza suboxidă apropiată de SiO1,5 38. Aceasta ar putea fi interpretată ca o acoperire neuniformă, implicând aproape compus SiO2 la suprafață și SiOx (X 13 .
Proprietățile LA-da QD-uri.
(A) Spectrele fotoluminescente ale LA-da filme nanostructurate (curbă roșie) și suspensii apoase de LA-da NP (curba neagră); (b) tranzitoriu tipic PL pentru banda exciton (1,5 eV). Inserția arată tranzitorie PL pentru banda legată de defecte la 2.7 eV; (c) Spectre dinamice de împrăștiere a luminii din LA-da Aglomeratele QD după un timp diferit de depozitare în ser fiziologic.
Eficientul PL din filme ablate cu laser și suspensii de da QD-urile sunt o surpriză plăcută, ținând cont de asta da nanostructurile produse de majoritatea metodelor alternative uscate, cum ar fi piroliza cu laser a silanului 1,22,26, nu oferă luminescență înainte de o etapă suplimentară de tratament chimic umed în soluții de HF-HNO3. Credem că formarea de QD-uri puternic luminiscente în cazul nostru se datorează condițiilor particulare de creștere a cristalului în panoul laser-plasmă și pasivarea lor ulterioară în aerul ambiant. Se știe că nuanta de ablat da nanoclustrii sunt capabili să ionizeze în mod eficient atomii din mediul ambiant El gaz și astfel formează plasmă cu o durată de viață relativ lungă (> 1 ms) 47. Vizibilă cu ochiul liber datorită emisiilor caracteristice de luminiscență, o astfel de regiune a plasmei cu gaz ionizat poate atinge distanțele de 1,5-2 cm de la țintă. Deși nanoclustrii se mișcă cu o viteză relativ mare (
In vitro imagistică a LA-da PN în celulele canceroase.
Imagini de microscopie fluorescentă confocală a celulelor canceroase CF2Th incubate cu LA-da PN (colorate în roșu, roz și parțial violet) sub diferite scale de mărirea - c) și a unui eșantion de control fără NP (d). Panou (c) prezintă celulele după spălarea din LA-da QD-uri din spațiul extracelular. Nucleii celulelor sunt de culoare albastră, citoplasma lor este de culoare verde în panouri (b - d).
Astfel, incubația da QD-urile în celulele vii nu provoacă efecte de toxicitate, în timp ce PN-urile pătrund cu ușurință în celule și se concentrează în diferite regiuni celulare, cu excepția nucleelor. Prezența NP-urilor poate fi urmărită eficient de emisia roșie și albastră a benzilor PL de da QD-uri.
Concluzii
În concluzie, am pregătit și investigat ablat cu laser da nanoparticule compuse din mici da QDs ca agenți de contrast noi pentru bioimagistica fotoluminiscentă. Nanoparticulele au fost produse prin metode de ablație laser pulsată de la a c-Si țintă în gaz (El) ambianță, urmată de măcinarea cu ultrasunete a filmelor depuse cu laser în soluții apoase. Prin urmărirea semnalelor de fotoluminescență din da QD-uri am evidențiat absorbția excelentă da nanoparticule de către celulele canceroase și acumularea lor eficientă în diferite regiuni celulare. Folosirea unor astfel de QD-uri nu relevă niciun semn de citotoxicitate reziduală, ceea ce le face să fie candidați extrem de promițători pentru sarcini de imagistică biologică.
Metode
La primul pas, am folosit o geometrie convențională de depunere laser pulsată în ambianță gazoasă. Radiația unui laser KrF pulsat (lungime de undă: 248 nm, lungime impuls: 17 ns, frecvență de repetare: 10Hz) a fost utilizată pentru ablația materialului dintr-o țintă rotativă c-Si (100) orientată c-Si napolitane de tip n, rezistență specifică de 10 Ohm · cm) 33. Radiația a fost focalizată pe un punct focal de 2 mm 2 pe țintă la unghiul incident de 45 ° dând intensitatea radiației de aproximativ 5 * 10 8 W/cm 2. Substraturile pe bază de napolitane c-Si, identice cu ținta, au fost așezate pe un suport de substrat rotativ la 2 cm de la țintă. Camera experimentală a fost pompată până la o presiune reziduală de 10-7 Torr înainte de a umple cu heliu (puritate 99,9995%) pentru o depunere la o presiune constantă de aproximativ 1-2 Torr. Grosimea filmului după zece mii de fotografii cu laser a fost de aproximativ 1 μm.
Suspensii apoase de LA-da PN-urile au fost obținute prin tratarea cu ultrasunete a filmelor ablate cu laser în apă deionizată sau soluție salină (0,9% NaCI în H2Oh) pentru 1 h. Densitatea puterii și frecvența ultrasunetelor au fost de 5 W/cm 2 și 44 kHz, respectiv.
Imaginile cu microscopie electronică de scanare (SEM) au fost obținute utilizând un microscop Tescan Lyra 3 XM cu rezoluție de 1,2 nm și tensiunea de accelerare de 30 kV. Imaginile cu microscopie electronică de transmisie (TEM) au fost obținute cu ajutorul unui microscop Zeiss Libra 120 cu rezoluție de 0,5 nm și o tensiune de accelerare de 120 kV. Imaginile TEM de înaltă rezoluție au fost furnizate de un microscop JEOL JEM-2100F cu rezoluție de 0,8 Å și tensiune de accelerare de 200 kV. Distribuțiile de dimensiuni ale NP-urilor și QD-urilor au fost calculate utilizând software-ul ImageJ.
Spectrele PL au fost măsurate folosind un spectrometru SOLAR echipat cu o unitate CCD de la Hamamatsu. Toate spectrele au fost corectate pentru răspunsul spectral al sistemelor de măsurare. Tranzitorii PL au fost detectați de un tub fotomultiplicator R928 (Hamamatsu Photonics, Hamamatsu, Shizuoka, Japonia) sub iradiere laser pulsată de un laser cu azot (lungimea de undă de excitație de 337 nm și durata pulsului de 10 ns). Timpul de răspuns al sistemului de detectare a fost mai mic de 1 μs. Randamentul cuantic PL a fost măsurat prin compararea intensității PL și a absorbției probelor cu soluții de rodamină 6 G (PL QY aproximativ 100%).
Pentru a minimiza zgomotele din măsurătorile Raman, am depus o picătură de soluție apoasă de LA-Si NPs pe probe de oțel inoxidabil. În plus, într-un experiment separat, am depus straturi de Si nanostructurate pe substraturi de CaF2. Spectrele Raman au fost măsurate utilizând un spectrometru micro-Raman de la Horiba Jobin Yvon, lungimea de undă de excitație a fost 488 nm, densitatea maximă a puterii de excitație a fost de 10 L/cm 2, rezoluția spectrală a fost de 0,1 cm −1 . Pentru a evita încălzirea nefavorabilă a fost utilizat un set de filtre atenuante (0,3, 0,6, 1 și 2 dB). Distribuțiile de dimensiuni ale NP-urilor au fost măsurate utilizând un Zetasizer ZS de la Malvern cu împrăștiere dinamică a luminii (DLS). Porozitatea LA-da filme și compoziția LA-da PN-urile au fost studiate cu un spectrometru cu infraroșu transformat Fourier (FTIR) Bruker IFS 66v/S. Înainte de a măsura spectrele FTIR, suspensiile de LA-da NP-urile au fost depuse pe un cristal ATR și apoi uscate în aer și evacuate la 10-3 Torr.
In vitro s-au efectuat experimente de bioimagistică cu celule CF2Th (timus de câine) infectate cu o genă a proteinei fluorescente verzi (GFP). Acesta din urmă a fost indus de un inductor RSL-1 adăugat la cultura CF2Th cu 30 de ore înainte de analiza bioimagistică. GFP a fost caracterizat printr-o linie de fluorescență la 515 nm (lumină verde). LA-da NP-urile au fost introduse în cultura celulară 5 h după injectarea inductorului și 25 h înainte de experiment. 30 min înainte de experiment, nucleele celulare erau îmbibate cu 5 mg Hoechst, care era luminescent aproape de 460 nm (lumină albastră). Celulele care conțin LA-da PN-urile au fost studiate folosind un microscop fluorescent confocal Leica TCS SP5 cu iluminare multicoloră la 488 nm, 496 nm, 514 nm, 543 nm și 633 nm pentru a asigura excitația simultană atât a QD-urilor de Si, cât și a celulelor colorate cu GFP și colorate cu colorantul Hoechst.
informatii suplimentare
Cum să citiți acest articol: Gongalsky, M. B. și colab. Puncte cuantice Si strălucitoare pasivate cu oxid sintetizat cu laser pentru bioimagistică. Știință. reprezentant. 6, 24732; doi: 10.1038/srep24732 (2016).
- Cum să speli o pernă pentru a o menține mirosind proaspăt - Rapoarte ale consumatorilor
- Jamie; s Revoluția alimentară; Antologia spoturilor luminoase
- Cum intră oamenii în calea apei curate - Scientific American
- Love Handles Învață aceste metode științifice de pierdere a grăsimii pentru a le elimina
- Conferința internațională științifică și practică; Nutriție sănătoasă - Națiune sănătoasă; a avut loc la