Martina Goffredo
1 Departamentul de Pediatrie, Școala de Medicină a Universității Yale, 330 Cedar Street, P.O. Box 208064, New Haven, CT 06520, SUA; [email protected] (M.G.); ti.liamtoh@ininnaigomisoc (C.G.); [email protected] (E.D.); [email protected] (B.P.); [email protected] (S.C.)
Nicola Santoro
1 Departamentul de Pediatrie, Școala de Medicină a Universității Yale, 330 Cedar Street, P.O. Box 208064, New Haven, CT 06520, SUA; [email protected] (M.G.); ti.liamtoh@ininnaigomisoc (C.G.); [email protected] (E.D.); [email protected] (B.P.); [email protected] (S.C.)
Domenico Tricò
2 Departamentul de Medicină Internă, Școala de Medicină a Universității Yale, 300 Cedar Street, P.O. Box 208020, New Haven, CT 06520, SUA; [email protected]
3 Departamentul de Medicină Clinică și Experimentală, Universitatea din Pisa, Pisa PI 56126, Italia
Cosimo Giannini
1 Departamentul de Pediatrie, Școala de Medicină a Universității Yale, 330 Cedar Street, P.O. Box 208064, New Haven, CT 06520, SUA; [email protected] (M.G.); ti.liamtoh@ininnaigomisoc (C.G.); [email protected] (E.D.); [email protected] (B.P.); [email protected] (S.C.)
4 Departamentul de Pediatrie, Universitatea din Chieti, Chieti CH 66100, Italia
Ebe D’Adamo
1 Departamentul de Pediatrie, Școala de Medicină a Universității Yale, 330 Cedar Street, P.O. Box 208064, New Haven, CT 06520, SUA; [email protected] (M.G.); ti.liamtoh@ininnaigomisoc (C.G.); [email protected] (E.D.); [email protected] (B.P.); [email protected] (S.C.)
4 Departamentul de Pediatrie, Universitatea din Chieti, Chieti CH 66100, Italia
Hongyu Zhao
Gang Peng
Xiaoqing Yu
Tukiet T. Lam
6 Departamentul de Biofizică Moleculară și Biochimie, Școala de Medicină a Universității Yale, New Haven, CT 06520, SUA; [email protected]
Bridget Pierpont
1 Departamentul de Pediatrie, Școala de Medicină a Universității Yale, 330 Cedar Street, P.O. Box 208064, New Haven, CT 06520, SUA; [email protected] (M.G.); ti.liamtoh@ininnaigomisoc (C.G.); [email protected] (E.D.); [email protected] (B.P.); [email protected] (S.C.)
Sonia Caprio
1 Departamentul de Pediatrie, Școala de Medicină a Universității Yale, 330 Cedar Street, P.O. Box 208064, New Haven, CT 06520, SUA; [email protected] (M.G.); ti.liamtoh@ininnaigomisoc (C.G.); [email protected] (E.D.); [email protected] (B.P.); [email protected] (S.C.)
Raimund I. Herzog
2 Departamentul de Medicină Internă, Școala de Medicină a Universității Yale, 300 Cedar Street, P.O. Box 208020, New Haven, CT 06520, SUA; [email protected]
Date asociate
Abstract
1. Introducere
În paralel cu epidemia mondială de obezitate infantilă, boala hepatică grasă nealcoolică (NAFLD) a devenit cea mai frecventă cauză a bolilor hepatice în practica pediatrică, cu o prevalență a
30% și spânzură adolescenții [1]. NAFLD cuprinde un spectru larg de boli, variind de la steatoza simplă la steatohepatita nealcoolică (NASH), care la rândul său poate evolua către ciroză și boală hepatică în stadiu final [2]. Tinerii obezi cu NAFLD prezintă un risc ridicat de a dezvolta dislipidemie, diabet zaharat tip 2 (T2DM) și boli cardiovasculare [3,4,5]. În special, studiile anterioare au arătat că ficatul gras la adolescenții obezi este puternic asociat cu rezistența la insulină hepatică și periferică, independent de obezitate [3]. Căile metabolice care stau la baza acestor asociații și în special dezvoltarea rezistenței la insulină hepatică rămân în mare parte neclare.
La adulți, studii recente au raportat în mod constant concentrații crescute de aminoacizi cu lanț ramificat (BCAA) și metaboliții lor în NAFLD și NASH [6,7,8,9,10,11]. Mai mult, modificările BCAA și ale acilcarnitinelor derivate din BCAA au fost implicate în dezvoltarea rezistenței la insulină și a T2DM [12,13,14], sugerând astfel că modificările metabolismului BCAA ar putea juca un rol în dezvoltarea rezistenței la insulină și a ficatului gras.
Pentru a umple acest gol în cunoștințe, am aplicat o abordare metabolomică țintită pentru a explora dacă, independent de obezitate și rezistența la insulină în sine, adolescenții obezi cu afecțiuni hepatice grase prezintă o semnătură metabolomică în concordanță cu tulburări ale metabolismului aminoacizilor și lipidelor. Mai mult, am evaluat dacă modificările metabolice ar putea prezice modificări longitudinale ale acumulării intra-hepatice de grăsime.
2. Metode
2.5. Imagistica prin rezonanță magnetică abdominală
Conținutul de grăsime hepatică a fost măsurat prin RMN pe un sistem GE sau Siemens Sonata 1.5 Tesla [30], utilizând metoda Dixon în două puncte (2PD) modificată de Fishbein și colegii [31]. Pe scurt, utilizând programul software MRIcro (Dr. Chris Rorden, Universitatea din Carolina de Sud, Columbia, SC, SUA; disponibil la http://people.cas.sc.edu/rorden/mricro/mricro.html), cinci regiuni din s-a atras interes pe fiecare imagine și s-a înregistrat nivelul mediu al intensității semnalului pixelilor. HFF a fost calculat în duplicat din datele medii privind intensitatea semnalului pixelului utilizând formula: [(Sin-Sout)/(2 × Sin)] × 100. Parametrii de imagine au fost: dimensiunea matricei = 128 × 256, unghiul de rotație (α) = 30 °, TR = 18 ms, TE = 2,38/4,76 ms defazat și respectiv în fază, lățime de bandă = 420 Hz/pixel, șase medii, grosimea feliei = 10 mm, o felie, 2,3 s/felie ( timp de 2 puncte), timpul de scanare = 14 s într-o singură reținere a respirației [31].
Un subgrup de 23 de copii și-a dat consimțământul de a participa la urmărirea longitudinală și de a face un al doilea RMN după aceea
2 ani. Rațiunea pentru intervalul de timp de doi ani a fost evaluarea modificărilor HFF pe o perioadă relativ scurtă, reducând în același timp prejudecățile introduse de factorii de mediu.
2.6. Analize statistice
3. Rezultate
3.1. Profiluri antropometrice și metabolice
Pentru a disocia efectele confuzive ale obezității de cele ale ficatului gras asupra profilului metabolomic, am recrutat adolescenți cu un grad general similar de obezitate cu sau fără NAFLD. Astfel, cele două grupuri de subiecți au fost asortate pentru IMC, scor z IMC și grăsime corporală, precum și pentru vârstă (Tabelul 1). Cu toate acestea, cele două grupuri au diferit în funcție de sex și etnie, reflectând prevalența mai mare a NAFLD la băieți și la hispanici descrisă în literatură [35]. După cum sa raportat anterior, adolescenții obezi cu ficat gras, independent de obezitate, au avut niveluri ridicate de insulină, trigliceride și transaminaze, împreună cu prezența unei sensibilități reduse la insulină la nivelul întregului corp (WBISI) [36]. Caracteristicile clinice și metabolice ale celor două subgrupuri de subiecți care au suferit o clemă hiperinsulinemică-euglicemică și/sau un RMN abdominal de urmărire sunt prezentate în tabelele S1 și respectiv S2 și nu au fost diferite de cele ale întregii populații din studiu (Tabelul S3 ).
3.2. Semnătura metabolomicii tinerilor obezi cu NAFLD
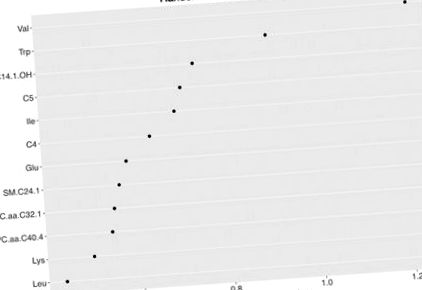
Analiza Random Forest (RF) a arătat că primii 12 metaboliți au avut o sensibilitate de 68,9% și o specificitate de 64,7% pentru a detecta NAFLD (Figura 1). Dintre cei 168 de compuși originali (Tabelul S4, Figurile S1 - S4), 10 metaboliți au prezentat o diferență între cele două grupuri în analiza preliminară; în special, subiecții cu NAFLD au prezentat niveluri plasmatice mai ridicate de BCAA (valină, leucină, izoleucină), triptofan, lizină, glutamat, precum și esteri de carnitină C4, C5 și C14: 1-OH și fosfatidilcolină cu lanț lung C32: 1 (PC.aa.C32.1) (Figura 2). După corecție pentru comparații multiple și ajustarea factorilor de confuzie (vârstă, sex, etnie, IMC și sensibilitate la insulină), diferențele de valină plasmatică (p = 0,02), izoleucină (p = 0,03), triptofan (p = 0,02) și lizină (p = 0,02) a rămas semnificativă statistic.
Complot aleatoriu de importanță a pădurii pentru subiecți fără vs. cu boală hepatică grasă nealcoolică (NAFLD). Complot forestier aleatoriu de metaboliți de top cu cel mai mare indiciu mediu Gini scăzut pentru clasificarea adolescenților obezi cu și fără NAFLD.
Metaboliții asociați cu NAFLD la tinerii obezi:(A) BCAA, aminoacizi cu lanț ramificat (izoleucină, leucină și valină); (B) C4 și C5; (C) triptofan, lizină și glutamat; (D) PC.aa.C32.1 (fosfatidilcolină cu lanț lung C32: 1); și (E) C14: 1-OH (hidroxitetradecenilcarnitină). Comparațiile statistice între cele două grupuri au fost făcute prin testele t ale Studentului.
3.3. Asocieri între aminoacizi cu lanț ramificat și sensibilitate la insulină hepatică
Am găsit o corelație negativă între nivelurile WBISI derivate din OGTT și izoleucina plasmatică (r = -0,318; p = 0,005) și valina (r = -0,369; p = 0,001) în întreaga populație din studiu. Mai mult decât atât, aceiași aminoacizi au fost și mai puternic asociați cu rata de eliminare a glucozei, un marker al rezistenței la insulină musculară derivat din studii hiperinsulinemice de clamp (izoleucină r = -0,61, p = 0,036; valină r = -0,58, p = 0,048). De asemenea, am observat o asociere independentă între BCAA și suprimarea procentuală a producției hepatice de glucoză în timpul primului pas (doză mică de insulină) a clemei (r = -0,70; p = 0,013 pentru izoleucină și r = -0,79; p = 0,002 pentru leucină ), așa cum se arată în Figura 3. În general, aceste date arată că BCAA circulante au fost asociate cu sensibilitate la insulină periferică și hepatică.
Asocierea dintre supresia hepatică a glucozei în timpul unei cleme hiperinsulinemice-euglicemice în două etape și:(A) izoleucină; (B) leucina; și (C) concentrațiile de valină. Corelațiile de rang între variabile sunt indicate de coeficientul de corelație de rang al lui Spearman (r).
3.4. Corelația dintre concentrația de metabolit și modificările conținutului de grăsime hepatică în timp
Conținutul de grăsime hepatică (HFF) de la 23 de copii a fost reevaluat după o urmărire de 2,2 ± 0,8 ani (Tabelul S2). După urmărire, a existat o creștere de 34% a HFF (p = 0,02) și o creștere de 8% a IMC (p = 0,0003). Interesant, niveluri inițiale mai ridicate de valină au fost identificate la copii ale căror HFF a crescut în perioada de urmărire (n = 12; 296 ± 53 μmol/L) decât la acei subiecți a căror HFF a rămas stabilă sau scăzută (n = 11; 246 ± 29 μmol/L; p = 0,01). Zona de sub curba ROC a valinei plasmatice pentru prezicerea progresiei HFF la tinerii obezi a fost de 0,803 (Figura 4). Nivelurile de valină mai mari de 276 μmol au avut 66,7% sensibilitate și 90,9% specificitate pentru a prezice creșteri ale HFF.
Curba caracteristică de funcționare a receptorului (ROC) a valinei pentru prezicerea progresiei HFF la tinerii obezi. Zona de sub curba ROC a fost de 0,803. Cu o limită de 276 μmol, nivelurile de valină au avut 66,7% sensibilitate și 90,9% specificitate pentru a prezice creșteri ale HFF.
4. Discutie
În acest studiu, am observat că adolescenții obezi cu afecțiuni hepatice grase prezintă o semnătură metabolomică caracterizată prin creșterea aminoacizilor plasmatici, inclusiv doi BCAA (valină și izoleucină), triptofan și lizină, care este independent de obezitate și rezistență la insulină. Important, am constatat că nivelurile de BCAA sunt asociate cu gradul de rezistență la insulină hepatică și periferică; în special, concentrațiile mari de BCAA au fost corelate negativ cu capacitatea insulinei de a suprima producția hepatică de glucoză, precum și cu rata de eliminare a glucozei. Mai mult, nivelurile inițiale de valină au fost predictive pentru modificările longitudinale ale acumulării de grăsime hepatică în timpul urmăririi de doi ani. Aceste descoperiri au o relevanță deosebită, deoarece sugerează că o modificare timpurie a metabolismului BCAA ar putea juca un rol în dezvoltarea și progresia NAFLD în rândul tinerilor obezi.
Interesant, am arătat că alți aminoacizi, cum ar fi triptofanul, lizina și glutamatul, sunt crescute la subiecții obezi cu NAFLD. Este de conceput că aceștia pot concura cu BCAA pentru transportatorii de aminoacizi de pe organele țintă, rezultând o absorbție redusă a țesutului BCAA și catabolism [43,44,45]. În plus, modificările microbiotei intestinale, care au fost propuse recent ca contribuabili cheie la patogeneza NAFLD [46], pot crește BCAA circulante [47,48], stimulând biosinteza de novo a aminoacizilor [48,49], prin încetinirea Catabolism BCAA [48], sau prin creșterea permeabilității intestinale [47,50].
Studiile longitudinale la adulți [51] și copii [19] au raportat anterior că concentrațiile plasmatice crescute de BCAA prezic independent dezvoltarea și progresia rezistenței la insulină sau T2DM. În studiul de față, arătăm că nivelurile de valină sunt predictive pentru modificările longitudinale ale acumulării de grăsime hepatică la copiii obezi. Deși este rezonabil să speculăm că afectarea timpurie a metabolismului BCAA poate contribui la dezvoltarea și progresia NAFLD și a rezistenței la insulină la subiecții obezi, indiferent dacă concentrațiile crescute de BCAA și metaboliții lor sunt factori cauzali sau doar biomarkerii rămân neclari și vor necesita o validare suplimentară în studii prospective dedicate. Au fost ipotezate mai multe căi care leagă concentrații ridicate de BCAA și subproduse BCAAs de acumularea de grăsime intra-hepatică în NAFLD [52].
5. Concluzii
Pe scurt, concentrațiile plasmatice ridicate de BCAA sunt asociate cu conținutul de grăsime intra-hepatică, independent de gradul de obezitate și rezistența la insulină și pot reprezenta legătura dintre rezistența la insulină hepatică și NAFLD la tinerii obezi. Înțelegerea căilor de semnalizare și metabolice ale BCAA ar putea indica noi potențiale ținte terapeutice pentru tratamentul NAFLD.
- Aminoacizii cu lanț ramificat exacerbează tulburările metabolice ale glucozei și lipidelor hepatice legate de obezitate
- Riscul cardiometabolic la adolescenții cu sau fără obezitate Băutură metabolică, nutrițională și răcoritoare
- Asocieri între profilurile metabolice ale aminoacizilor, lipidelor și glucozei la obezitatea infantilă BMC
- Factori de risc cardiometabolici legați de vitamina D și adiponectină la copii și adolescenți obezi
- O investigație preliminară a unui program de sănătate și sănătate pentru adolescenții supraponderali și obezi