Rebecca A.S. Palu
1 Departamentul de genetică umană, Facultatea de Medicină a Universității din Utah, Salt Lake City, UT 84112, SUA
Carl S. Thummel
1 Departamentul de genetică umană, Facultatea de Medicină a Universității din Utah, Salt Lake City, UT 84112, SUA
Abstract
În acest număr al Developmental Cell, Okamoto și Nishimura (2015) identifică o buclă de feedback pozitiv între celulele neuronale care menține semnalizarea și creșterea insulinei în condiții nutriționale restrânse.
Okamoto și Nishimura (2015) au confirmat mai întâi că expresia dilp5 este reprimată de foame și au constatat că hrănirea animalelor o dietă bogată - sau una care conține în principal aminoacizi, dar nu lipide sau carbohidrați - este suficientă pentru a restabili expresia dilp5. În plus, în timp ce mutanții dilp5 prezintă o creștere a larvelor relativ normală pe medii bogate, aceștia au redus creșterea atunci când sunt menținuți în condiții restricționate de nutrienți. Luate împreună cu alte experimente, aceste rezultate ridică modelul interesant că reglarea nutrienților a expresiei dilp5 este necesară pentru a menține creșterea larvelor în condiții dietetice suboptime. Mai mult, autorii arată că întreruperea căii TOR de detectare a aminoacizilor în IPC nu are niciun efect asupra expresiei dilp5, indicând faptul că alte celule trebuie să simtă aminoacizi derivați de nutrienți pentru a controla producția de dilp5. Aceste observații i-au determinat pe autori să întreprindă un studiu detaliat al reglării dilp5 și au condus la descoperirea unui sistem de semnalizare la distanță care menține Dilp5 ca răspuns la semnalele dietetice (Figura 1).
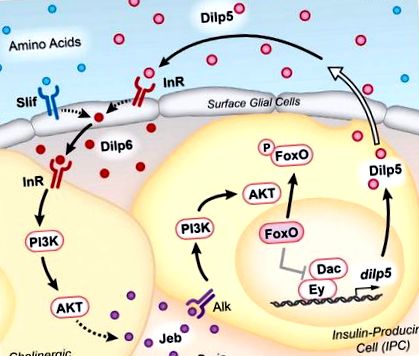
Dilpii circulanți, împreună cu aminoacizii dietetici, promovează producția Dilp6 de către celulele gliale de suprafață. Acest ligand activează InR pe suprafața neuronilor colinergici, în imediata apropiere atât a gliei, cât și a IPC-urilor. IIS din neuronii colinergici duce la secreția Jeb, care activează receptorul Alk pe IPC. Activarea în aval a căii de semnalizare PI3K/AKT duce la fosforilare și excludere nucleară a Foxo. În absența IIS, Foxo nuclear reglează negativ factorii de transcripție Ey și Dac pentru a suprima expresia dilp5. Dilpurile derivate din IPC sunt secretate în hemolimfă prin proiecții către sistemul circulator (reprezentat de săgeata deschisă), completând bucla de feedback pozitiv.
În mod neașteptat, deși calea PI3K/AKT este necesară în IPC-uri pentru expresia dilp5, InR nu este. Prin screening-ul cunoscutului tirozin kinază al receptorilor Drosophila folosind interferența ARN, Okamoto și Nishimura (2015) au identificat limfom kinaza anaplastică (Alk) ca receptor în această cale. În plus, ligandul Alk, Jellybelly (Jeb), este atât necesar, cât și suficient în neuronii colinergici pentru exprimarea dilp5 în IPC. Acești neuroni stau la baza gliei suprafeței și înconjoară IPC-urile, oferind contacte celulare directe care pot facilita semnalizarea. Important, supraexpresia Jeb în neuronii colinergici lipsiți de InR este suficientă pentru a induce expresia dilp5, plasând activarea Dilp6 a IIS în neuronii colinergici în amonte de activarea Alk și transcrierea dilp5 în IPC (Figura 1). Autorii subliniază că dependența de semnalizarea Alk în IPC menține sensibilitatea la o gamă de niveluri nutriționale. Acest lucru se datorează faptului că nivelurile de Alk nu sunt afectate de starea nutrițională, în timp ce InR este reglementat negativ de nutriție și IIS. Astfel, folosirea semnalizării Jeb-Alk de către IPC îi permite să mențină o buclă de feedback pozitiv între Dilps secretat și expresia dilp5, independent de starea nutrițională.
Autorii completează bucla realizând o serie de studii detaliate de reglare transcripțională dilp5, bazându-se pe lucrările lor anterioare, arătând că factorii de transcripție Ey și Dac promovează direct expresia dilp5 în IPC (Okamoto și colab., 2012). Foxo Nuclear poate interacționa direct cu Ey, perturbând complexul proteic Ey-Dac și astfel reglând în jos expresia dilp5 în condiții de foame. Astfel, menținerea Foxo citoplasmatică prin semnalizarea Jeb-Alk poate susține expresia dilp5 în condiții nutriționale limitate.
Acest studiu realizat de Okamoto și Nishimura (2015) oferă un model pentru a explica modul în care larvele își mențin creșterea în condiții nutriționale restrânse (Figura 1). După cum subliniază autorii, expresia dilp2 rămâne relativ constantă în condiții nutriționale în schimbare, în timp ce peptida Dilp2 este secretată rapid de IPC ca răspuns la semnalele nutriționale, oferind un mecanism de răspuns rapid pe lângă nivelurile susținute ale expresiei dilp5. Experimentele viitoare care examinează secreția Dilp5 de către IPC-uri pot aborda gradul în care aceasta ar putea contribui la funcțiile sale. În plus, sunt necesare lucrări suplimentare pentru a defini mai bine expresia și secreția Jeb de către neuronii colinergici (Okamoto și Nishimura, 2015). În cele din urmă, autorii subliniază faptul că un alt receptor decât InR a fost propus pentru a explica capacitatea celulelor β de a susține IIS în condiții nutriționale în schimbare, iar similitudinea secvenței dintre Alk mamifer și receptorii insulină/IGF-I sugerează că Alk poate îndeplini acest lucru rol (Rhodes și colab., 2013). În plus, se știe că neuronii colinergici reglează celulele β, sugerând că interacțiunile funcționale descoperite de autori sunt conservate prin evoluție și pot oferi noi direcții pentru înțelegerea fiziologiei celulelor β (Gilon și Henquin, 2001).
- Cum afectează mineralele și nutrienții creșterea plantelor Întrebări frecvente despre grădinărit
- Cum să mănânci pentru o creștere musculară maximă la orice vârstă!
- Creșterea inadecvată în greutate la femeile gravide supraponderale și obeze, care este efectul asupra creșterii fetale
- Cum să obțineți cei mai buni nutrienți din fructele și legumele dvs. Nutriție
- Influența dietelor bogate în grăsimi asupra creșterii și dezvoltării obezității la șobolanul Albino