Yael Aylon
Departamentul de biologie celulară moleculară, Institutul de Științe Weizmann, Rehovot, Israel
Moshe Oren
Departamentul de biologie celulară moleculară, Institutul de Științe Weizmann, Rehovot, Israel
ASBTRACT
Ratele crescute de colesterol și sinteza lipidelor au fost recunoscute de mult ca aspecte importante ale recablării metabolice care are loc în timpul transformării canceroase. Multe gene care codifică enzime implicate în colesterol și în biogeneza acizilor grași sunt ținte transcripționale ale proteinelor de legare a elementelor de reglare a sterolului (SREBP). SREBP-urile acționează ca un hub pentru semnale metabolice și legate de proliferare; activitatea lor este punctul central al unei trageri de război între supresoare tumorale, care inhibă în general funcția SREBP și oncogene, care promovează adesea și se bazează pe activitatea SREBP. Calea hipopotamului joacă un rol central în coordonarea proliferării celulare și a dimensiunii organelor, în timp ce p53 este un supresor crucial al tumorii care menține homeostazia metabolică și răspunsurile la stres celular al orchestrelor. Împreună, căile de semnalizare Hippo și p53 cooperează la mai multe niveluri pentru a regla fin activitatea SREPB și a regla nivelul colesterolului/lipidelor. Inhibitorii biosintezei colesterolului, cum ar fi statinele, sunt atrăgători din punct de vedere conceptual, dar nu au demonstrat încă un efect incontestabil asupra dezvoltării cancerului. Din fericire, reglementarea complexă din jurul rețelei Hippo-p53-SREBP oferă potențial o interfață largă pentru noi intervenții suplimentare de direcționare a cancerului.
Introducere
Colesterolul este o lipidă unică, esențială pentru biogeneza membranei, proliferarea celulară și diferențierea celulară. 1 Este precursorul hormonilor steroizi, al acizilor biliari și al vitaminei D. Colesterolul este disponibil prin dietă, dar este sintetizat și de către ficat, intestinul subțire și gros și țesuturile suplimentare. Este distribuit în tot corpul prin intermediul transportorilor de lipoproteine cu densitate mică (LDL) și lipoproteine cu densitate mare (HDL). Celulele mamiferelor sintetizează colesterolul printr-un proces enzimatic în mai mulți pași, generând numeroși metaboliți care mediază procesele fiziologice, de dezvoltare și tumorigenice. 1
S-a demonstrat că excesul de colesterol promovează creșterea tumorii mamare și invazivitatea în mai multe modele transgenice de șoarece. 2-4 La om, hipercolesterolemia este un factor de risc independent pentru cancerul de sân 5-7 și pentru răspunsul redus al tumorilor la terapiile endocrine. 8 Acest lucru se datorează parțial faptului că unii metaboliți ai colesterolului (cum ar fi 27-hidroxicolesterolul), deși diferiți în structură, pot avea moduri de acțiune similare cu estrogenul, crescând proliferarea celulelor canceroase de sân receptori estrogeni pozitivi. 9-11 De remarcat, s-a demonstrat că alți metaboliți asociați colesterolului inhibă tumorigeneză. 12
Nivelurile de colesterol celular sunt strâns legate de calea SREBP-mevalonat. 13 Genomul mamiferelor conține 2 gene SREBP: SREBP1 și SREBP2, care codifică factorii de transcripție specifici secvenței conexe. Împreună, proteinele SREBP activează direct o multitudine de gene dedicate sintezei și absorbției colesterolului, acizilor grași, trigliceridelor și fosfolipidelor. 13,14 SREBP1 reglează în principal biogeneza lipidelor, în timp ce genele implicate în sinteza colesterolului sunt transactivate predominant de SREBP2. 15-17 Două izoforme ale SREBP1, SREBP1a și SREBP1c, sunt generate prin utilizarea unor promotori alternativi; SREBP1c (cu un domeniu de transactivare mai scurt și, prin urmare, activitate transcripțională mai slabă) este exprimat predominant în ficat, în timp ce în alte organe SREBP1a este mai răspândit.
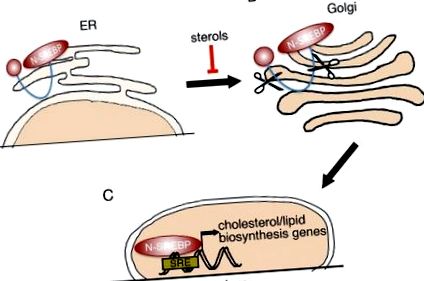
Toate cele trei proteine sunt sintetizate ca precursori inactivi (P-SREBP), legați de reticulul endoplasmatic (ER) 18 (Fig. 1A). Când celulele se epuizează de colesterol, proteinele P-SREBP sunt escortate la aparatul Golgi (Fig. 1B). În Golgi, P-SREBP este scindat consecutiv de 2 proteaze distincte, astfel încât să elibereze domeniul N-terminal, transcripțional activ (N-SREBP, Fig. 1C). N-SREBP intră în nucleu și promovează un program de sinteză lipogenică/colesterol prin legarea la siturile sale de consens. 14 Când conținutul de colesterol din celulă crește, P-SREBP-urile sunt reținute pe membrana ER, oprind transcrierea genelor țintă. 13 În acest fel, SREBP-urile afectează și sunt afectate de nivelul colesterolului celular.
Prelucrarea SREBP. (A) Factorii de transcriere SREBP sunt sintetizați ca precursori inactivi (P-SREBP), reținuți la membrana ER. Când nivelurile intracelulare de sterol devin scăzute, P-SREBP este eliberat din membrana ER și este translocat în aparatul Golgi. (B) SREBP în aparatul Golgi suferă 2 evenimente secvențiale de scindare proteolitică. (C) Partea N-terminală a SREBP (N-SREBP), care conține un domeniu de activare transcripțională și un domeniu de legare a ADN-ului, este translocată în nucleu, unde poate lega elementele de răspuns la steroli (SRE) și poate regla expresia țintei asociate gene.
LATS2 și p53 cooperează pentru a restrânge activitatea SREBP celulară
Nu este surprinzător faptul că SREBP-urile acționează ca un hub pentru semnale metabolice și legate de proliferare și sunt foarte reglementate de căile asociate cancerului. Împreună, acestea constituie o rețea de ordin superior care formează un cadru de bază moleculară pentru determinarea nivelurilor de colesterol celular în sănătate și boli, inclusiv în cancer. După cum sa discutat mai jos, supresoarele tumorale inhibă adesea activitatea SREBP, în timp ce oncogenele cresc și/sau sunt dependente de activitatea SREBP. Aceasta reprezintă o luptă cu miză mare pentru controlul metabolic, care este inevitabil coruptă atunci când celulele suferă o transformare neoplazică.
Calea de semnalizare Hippo este un regulator critic al proliferării și diferențierii celulare. Centrala acestei căi este o cascadă de kinază centrală a supresoarelor tumorale MST1/2, LATS1/2 și a proteinelor adaptoare SAV1 și MOB1/2. 19 sAceste proteine formează o casetă de kinază conservată („Hippo”) care limitează creșterea țesuturilor și proliferarea celulelor progenitoare, de obicei, prin fosforilarea și inactivarea co-activatorilor transcripționali YAP și TAZ. YAP/TAZ hipofosforilate sunt sechestrate în citoplasmă și sunt pregătite pentru degradarea rapidă a proteazomului, reprimând astfel activitățile lor transcripționale și efectele lor pozitive asupra creșterii și proliferării țesuturilor. 20-22 În țesuturile normale, integritatea căii Hippo ține celulele sub control și previne proliferarea necontrolată a acestora. Invers, disfuncția căii Hippo poate duce la activarea constitutivă a YAP/TAZ și este asociată cu multe tipuri de cancer. 23
p53 este un supresor major al tumorii, mutat inactivat în aproximativ jumătate din toate cazurile de cancer uman. 24,25 Având în vedere rolul său central în asigurarea integrității genomului și eliminarea celulelor care adăpostesc genomuri defecte, p53 a fost supranumit „gardianul genomului”. 26 În urmă cu câțiva ani, LATS2 - o componentă cheie a căii de bază Hippo - a contribuit la stabilizarea și activarea p53 ca răspuns la deteriorarea mașinilor mitotice și la activarea oncogenei 27, implicându-l ca membru al rețelei extinse care transmite p53 semnale de la mai multe tipuri de stres care pune în pericol genomul. Recent, LATS2, împreună cu paralogul său LATS1, s-a dovedit că contribuie la caracteristicile supresive tumorale canonice ale p53 și în condiții bazale, în absența unui stres genotoxic pronunțat. 28 Mai mult, p53 leagă și transactivează promotorul LATS2, definind astfel o buclă de feedback pozitivă. 27,29,30 (Fig. 2A și 3, „A”). Această axă LATS2-p53 cuplează intim două căi importante de supresoare tumorale, p53 și Hippo, nu numai ca răspuns la insultele genotoxice, ci și în procesele fiziologice, cum ar fi diferențierea celulară indusă. 31
LATS2 p53 și diabolica colesterolului. (A) LATS2 și p53 se reglează pozitiv reciproc, pentru a inhiba sinteza colesterolului. Nivelurile excesive de colesterol activează axa LATS2-p53. Săgețile verzi descriu reglarea pozitivă, iar liniile roșii denotă reglarea negativă. (B) Bistabilitatea propusă care reglementează angajamentul LATS2-p53, dependent de nivelul colesterolului. Răspunsul la intrarea în creștere (vârfuri de săgeată în sus) diferă de răspunsul la intrarea în scădere (vârfuri de săgeată în jos). Activarea LATS2-p53 este declanșată peste un prag al nivelului de colesterol, pentru a ajunge la starea „B.” Odată ce bucla de feedback este activă, aceasta își susține activitatea astfel încât pragul de inactivare să fie deplasat la niveluri mai scăzute de colesterol, pentru a ajunge la starea „A.” În acest fel, bucla de feedback oferă rezistență la fluctuațiile dintre stările „A” și „B”.
O imagine parțială a) rețelei de reglementare SREBP. Axa LATS2-WTp53 (A) inhibă procesarea P-SREBP (B) și transcrierea ARNm SREBP (C). Mutantul p53 (mutp53) leagă N-SREBP și îi mărește activitatea transcripțională (D). YAP/2AZ sunt dependente de calea mevalonatului pentru activitatea lor (E). AMPK inhibă procesarea P-SREBP (F). RNF20 ubiquitinează SREBP și determină degradarea acestuia (G).
Rețea cu SREBP
Procesele importante din celulă sunt de regulă strâns reglementate pe mai multe niveluri. Mai mult, căi separate și „liniare” se întrepătrund adesea pentru a forma rețele de semnalizare integrate și coordonate. Prin urmare, nu este surprinzător faptul că căile Hippo și p53 conversează cu metabolismul colesterolului prin mecanisme suplimentare dincolo de axa LATS2-p53 descrise mai sus.
După cum sa menționat deja, p53 reprimă transcripțional expresia SREBP1c, precum și a 2 dintre genele sale țintă lipogene, acidul gras sintază (FASN) și ATP citrat liasa (ACLY) 34 (Fig. 3, „C”). Mai mult, sub foamea glucozei p53 induce LIPIN1, un modulator cheie al SREBP. 39,40 Important, multe dintre aceste efecte transcripționale sunt exercitate de p53 și în condiții bazale, în absența unui stres notabil, permițând astfel p53 să regleze peisajul metabolic lipidic al celulelor și țesuturilor pertinente.
Câștigul funcțional al formelor mutante de p53 (mutp53) apare în aproximativ 50% din toate cazurile de cancer. 41 Interesant, s-a demonstrat că mutp53 leagă SREBP1 și SREBP2 și crește transcripția genelor lor țintă 42 (Fig. 3, „D”). În celulele care adăpostesc mutp53, reglarea ascendentă a căii mevalonate prin acest mecanism este suficientă pentru a perturba morfologia celulară și pentru a conduce fenotipuri maligne, cum ar fi invazia. 42 Astfel, tipul sălbatic (WT) și mutp53 adoptă o dualitate yin-yang de funcții opuse, WT p53 inhibând și mutp53 mărind activitatea SREBP. Acest lucru sugerează, de asemenea, că restricția producției de colesterol este centrală în rolul supresor al tumorii al WT p53.
După cum sa menționat mai sus, YAP/TAZ sunt efectorii din aval ai căii Hippo. În mod caracteristic, nivelurile de proteine YAP/2AZ și activitatea transcripțională sunt inhibate de kinazele LATS1/2. 21.43 Studiile recente 44-46 au arătat că caracteristicile YAP/TAZ de promovare a cancerului sunt dependente de colesterol și de activitatea căii SREBP-mevalonat (Fig. 3, „E”). Din punct de vedere mecanic, activitatea nucleară susținută YAP/TAZ, în asociere cu fosforilarea inhibitoare YAP/TAZ redusă, este legată de geranilgeranilarea RTP mici GTPaze 44 și integritatea citoscheletului F-actină, 45 ambele fiind reglementate de SREBP. La rândul său, YAP în sine poate facilita transcrierea mai multor gene implicate în metabolismul colesterolului. 45 De fapt, mutp53 și YAP interacționează fizic și conduc în mod cooperant transcrierea. În mod curios, inhibarea căii mevalonate, prin tratamentul cu statine, sa dovedit a reduce efectele transcripționale ale mutp53 într-o manieră dependentă de YAP. 47 Împreună, aceste observații sugerează că calea mevalonatului este crucială atât ca regulator în amonte, cât și ca efector în aval al funcțiilor oncogene mutp53 și YAP.
De remarcat, în studiile de mai sus, LATS1/2 par a fi dispensabile pentru fosforilarea YAP/TAZ ca răspuns la tratamentul cu statine; 44.45 acest lucru este incompatibil cu noțiunea că statinele funcționează printr-o cale liniară simplă de hipopotam. În special, activitatea YAP independentă de LATS1/2 a fost observată și în alte contexte48, ceea ce implică faptul că alte kinaze sunt, de asemenea, capabile să vizeze și să inhibe YAP/TAZ. Un candidat interesant ar putea fi proteina kinază activată cu AMP (AMPK), 49-51 un regulator principal al metabolismului și el însuși un inhibitor al procesării SREBP 52 (Fig. 3, „F”). Va fi interesant să dezvăluim evenimentele moleculare care anulează semnalizarea hiponică canonică și să ocolească reglarea negativă a YAP/TAZ cu LATS1/2.
În mod similar, unele funcții de supresie tumorală ale componentelor căii Hippo par a fi independente de YAP. 53 Într-adevăr, LATS2 are un spectru în creștere de funcții, inclusiv menținerea stabilității genomului, inducerea apoptozei, ciclul celular și controlul punctului de control al tetraploidiei, inhibarea migrației celulare și reglarea diferențierii celulelor stem, care se extind dincolo de reglementarea YAP/TAZ. 27,28,31,38,54-63 De asemenea, rolul LATS2 în inhibarea SREBP1/2 este independent de YAP. 32 Astfel, LATS2 pare să angajeze o strategie cu mai multe direcții pentru a inhiba activitatea SREBP, prin (1) legarea directă și inhibarea procesării citoplasmatic P-SREBP, 32 (2) reglarea în sus a nivelurilor de proteine p53 și, prin urmare, probabil creșterea efectului inhibitor al SREBP al lui p53., și (3) în mod concepibil, de asemenea, acționând, împreună cu LATS1, prin calea canonică Hippo, pentru a inhiba acumularea nucleară YAP, amortizând astfel indirect ieșirea SREBP dependentă de YAP. 45
Fără îndoială, activitatea SREBP este reglementată de o serie de factori dincolo de cei menționați mai sus. De exemplu, N-SREBP-urile mature sunt proteine instabile, foarte reglementate de ubiquitinare și degradare proteazomală. 64.65 Proteina RNF20 este o ligază E3 care determină în principal monubiquitilarea histonei H2B pentru a regla expresia genelor și caracteristicile legate de cancer. 66-68 Cu toate acestea, un raport recent 69 a asociat RNF20, de asemenea, cu omniprezentarea și degradarea proteasomală sporită a SREBP (Fig. 3, „G”). Interesant este că epuizarea RNF20 scade transcripția p53, 66 implicând încă un alt mecanism potențial de coordonare între suprimarea tumorii și sinteza colesterolului.
Reglarea procesării și compartimentării proteinelor evoluează adesea pentru a rezolva provocările intermediarilor căii toxice, reacțiile enzimatice concurente sau ratele de rotație lente. 73 În general, controlul post-translațional oferă o rată de răspuns rapidă. Un mecanism post-translațional eficient este activarea proteolitică a unei proteine reglatoare cheie, după cum este exemplificat de SREBP. Cu toate acestea, deoarece proteoliza este o reacție termodinamic favorabilă și ireversibilă, prevenirea prelucrării necontrolate prin ocluzie temporală și compartimentată, de ex. pentru ER în cazul P-SREBP, este avantajos pentru robustețea căii. Pe de altă parte, modificările covalente post-translaționale, în special fosforilarea, sunt reversibile rapid și permit proteinelor existente să comute între stările activate/inactivate fără a fi nevoie de sinteză de proteine de novo sau procesare proteolitică. 74 Cu toate acestea, ambele moduri de reglare post-translațională au un cost energetic ridicat de producere a proteinelor care ar putea rămâne în starea lor inactivă „risipitoare”, dacă celula nu se întâlnește cu un declanșator de activare adecvat.
Coordonarea transcrierii cu translocarea P-SREBP din ER și procesarea P-SREBP Golgi-tethered, ar putea culege beneficiile combinate ale ambelor niveluri de reglementare. Dezactivarea transcrierii și procesării SREBP ar putea constitui o „frână” dublă împotriva sintezei colesterolului nejustificat. Pe de altă parte, modularea gradului de inhibare post-translațională ar putea fi o metodă de tamponare a unui semnal transcripțional potențial zgomotos și ar putea evita acumularea de intermediari potențial voluminoși încorporați în membrana ER. Ubiquitinarea proteinelor și degradarea proteazomală reprezintă o formă mai extremă de control post-translațional; degradarea este incontestabil un proces ireversibil. Omniprezentarea mediată de RNF20 și degradarea proteazomală ulterioară a SREBP 69 (Fig. 3, „G”) ar putea reprezenta o ultimă soluție pentru a restricționa funcția SREBP.
Statine, prevenirea cancerului și tratamentul cancerului
Dincolo de rolul lor în scăderea nivelului de colesterol, statinele sunt propuse să aibă alte efecte inhibitoare asupra creșterii și diferențierii tumorii. 89.90 De exemplu, statinele pot exercita proprietăți antineoplazice benefice prin modificarea efectului inhibitor al apoptozei VEGF și limitarea secreției metaloproteinazelor matrice. 90,91 Din păcate, nu toate încercările de a determina impactul statinelor asupra cancerului au dat rezultate pozitive fără echivoc. 92 De exemplu, un studiu recent a concluzionat că tratamentul pe termen lung (10 ani) cu statine a dublat de fapt riscul de carcinom ductal invaziv și carcinom lobular invaziv la femeile aflate în postmenopauză. 93 Aceasta este o constatare desconcertantă, având în vedere optimismul general în ceea ce privește administrarea profilactică de statine ca strategie de prevenire a cancerului.
Țintirea căii mevalonate cu statine ar putea fi doar vârful aisbergului. Rețeaua complexă de reglementare din jurul funcției SREBP oferă o interfață mare pentru intervenții suplimentare de direcționare a cancerului. În același timp, din cauza buclelor de feedback și a controalelor redundante de siguranță la eșec, este posibil ca diferite componente ale rețelei să fie direcționate simultan. O mai bună înțelegere moleculară a reglării și dereglării SREBP, de către supresoare tumorale, cum ar fi LATS1/2 și p53 și oncogene, cum ar fi YAP/2AZ și mutp53, ar putea în cele din urmă să permită manipularea terapeutică a acestor interacțiuni, precum și să ofere fundamentul pentru o mai bună orientare personalizată tratamente cu inhibitori ai biosintezei colesterolului.
Dezvăluirea potențialelor conflicte de interese
Nu au fost dezvăluite potențiale conflicte de interese.