Corespondență către: dl. J. Slavin, lector principal, Departamentul de Chirurgie, Spitalul Universitar Royal Liverpool, clădirea UCD la etajul 5, Daulby Street, Liverpool, L69 3GA, Marea Britanie, Marea Britanie. ku.ca.looprevil@sspj
Telefon: 0044-151-706-4177 Fax: 0044-151-706-5826
Abstract
Infecția care complică necroza pancreatică duce la sepsis persistentă, sindromul disfuncției organelor multiple și reprezintă aproximativ jumătate din decesele care apar în urma pancreatitei acute. Cazurile severe datorate calculilor biliari necesită sfincterotomie endoscopică urgentă. Pacienții cu necroză pancreatică trebuie urmăriți cu tomografie computerizată îmbunătățită cu contrast în serie (CE-CT) și, dacă se suspectează infecția, trebuie efectuată aspirarea cu ac fin a zonei necrotice pentru bacteriologie (FNAB). Tratamentul necrozei sterile ar trebui să fie inițial neoperator. În prezența infecției este indicată necrosectomia. Deși în mod tradițional acest lucru a fost realizat prin intervenții chirurgicale deschise, procedurile minim invazive sunt o nouă alternativă promițătoare. Există multe probleme nerezolvate în gestionarea necrozei pancreatice. Acestea includ, utilizarea profilaxiei cu antibiotice, indicațiile precise și frecvența repetării CE-CT și FNAB și rolul hrănirii enterale.
INTRODUCERE
Pancreatita acută este frecventă, incidența în studii europene recente variind între 20 și 70 de cazuri la 100.000 de populații, cu o mortalitate globală cuprinsă între 3% și 8% [1-6]. Majoritatea cazurilor sunt secundare calculilor biliari sau excesului de consum de alcool. Activarea tripsinogenului în celulele acinare pancreatice este evenimentul critic de inițiere [7]. Aceasta duce la autodigestie a pancreasului, cu un răspuns inflamator localizat și apoi sistemic, care, dacă este marcat, duce la dezvoltarea sindromului de disfuncție a organelor multiple (MODS) și la moarte [8,9]. Aproximativ jumătate din decesele cauzate de pancreatită acută apar în prima săptămână după un atac. La pacienții care supraviețuiesc atacului inițial, o proporție dezvoltă zone de necroză pancreatică și peripancreatică. Infecția secundară duce apoi la sepsis persistent, MODS și reprezintă cea mai mare parte a deceselor târzii rămase [1,10].
IDENTIFICAREA PACIENTILOR CU NECROZĂ
Aproape toți pacienții care suferă un atac ușor de pancreatită acută recuperează complet [11]. Aproximativ o treime din pacienții cu un atac sever, care dezvoltă insuficiență de organ în prima săptămână, vor dezvolta ulterior necroză pancreatică care implică mai mult de 30% din glandă. Există mai multe metode care sunt utilizate în mod obișnuit pentru identificarea precoce a pacienților care sunt susceptibili să dezvolte insuficiență de organ și a celor care vor fi expuși riscului de necroză pancreatică. Sistemele clinice de notare patologice specifice includ cele descrise de Imrie [12] și Ranson [13]. Cu toate acestea, acestea sunt corecte doar la 48 de ore după internarea în spital, atunci când clasifică corect aproximativ 80% dintre pacienți în ușori și severi. Un scor APACHE II ≥ 9 la internarea în spital identifică corect aproximativ 85% dintre pacienții care vor suferi un atac sever [14]. Din păcate, complexitatea relativă a sistemului APACHE II limitează utilizarea sa clinică.
Nivelurile de proteine reactive plasmatice C (CRP), mai mari de 150 mg/L 48 de ore după internare, sunt utilizate pe scară largă pentru a prezice un atac sever de pancreatită [15,16]. Nivelurile CRP nu ating totuși vârful până la șaptezeci și două de ore de la apariția simptomelor, astfel nivelurile CRP, cum ar fi scorurile Imrie și Ranson, sunt limitate în prezicerea unui atac sever în primele câteva ore după admitere (Tabelul (Tabelul 1). Nivelurile plasmatice ale altor mediatori inflamatori direcți, cum ar fi interleukina-8 și interleukina-6, sunt crescute mai devreme în cursul unui atac de pancreatită acută și se referă la severitatea răspunsului inflamator sistemic [17]. Deși nivelurile acestor mediatori sunt la fel de exacte la momentul admiterii ca și scorul APACHE II, sistemele de testare nu sunt adecvate pentru utilizarea clinică pe scară largă. Nivelurile urinare ale peptidei de activare a tripsinei (TAP), peptida de scindare eliberată în urma activării tripsinogenului, cresc semnificativ odată cu declanșarea unui atac, iar măsurarea TAP s-a dovedit a fi un predictor valoros al bolilor severe [18] și al nivelurilor TAP urinare. poate constitui în cele din urmă baza unui test simplu de urină la noptieră (Tabel (Tabelul 1 1).
tabelul 1
Acuratețea pronosticului APACHE II, scorurile Imrie și Ranson, CRP plasmatic și nivelurile TAP urinare [18]
| Sistem de punctare | Sensibilitate | Specificitate | PPV | VAN | Precizie |
| % | % | % | % | % | |
| Post-simptom 24 ore | |||||
| TAP urinar> 35 nmol/L | 58 | 73 | 39 | 86 | 70 |
| CRP plasmatic> 150 mg/L | 0 | 90 | 0 | 75 | 69 |
| CRP plasmatic> 150 mg/L | |||||
| sau TAP urinar> 35 nmol/L | 58 | 72 | 37 | 86 | 69 |
| CRP plasmatic> 150 mg/L și | |||||
| TAP urinar> 35 nmol/L | 0 | 92 | 0 | 74 | 70 |
| Post-simptom 48 ore | |||||
| TAP urinar> 35 nmol/L | 81 | 71 | 42 | 94 | 73 |
| CRP plasmatic> 150 mg/L | 65 | 73 | 37 | 90 | 72 |
| CRP plasmatic> 150 mg/L | |||||
| sau TAP urinar> 35 nmol/L | 86 | 60 | 35 | 94 | 65 |
| CRP plasmatic> 150 mg/L și | |||||
| TAP urinar> 35 nmol/L | 60 | 85 | 50 | 90 | 80 |
| Post-spitalizare 24 ore | |||||
| TAP urinar> 35 nmol/L | 68 | 74 | 44 | 89 | 73 |
| CRP plasmatic> 150 mg/L | 47 | 82 | 42 | 84 | 74 |
| CRP plasmatic> 150 mg/L sau | |||||
| TAP urinar> 35 nmol/L | 74 | 66 | 38 | 90 | 68 |
| CRP plasmatic> 150 mg/L și | |||||
| TAP urinar> 35 nmol/L | 40 | 91 | 57 | 83 | 79 |
| APACHE II ≥ 8 | 63 | 73 | 38 | 88 | 71 |
| Post-spitalizare 48 ore | |||||
| TAP urinar> 35 nmol/L | 83 | 72 | 44 | 94 | 74 |
| CRP plasmatic> 150 mg/L | 86 | 61 | 37 | 94 | 66 |
| CRP plasmatic> 150 mg/L sau | |||||
| TAP urinar> 35 nmol/L | 94 | 49 | 32 | 97 | 58 |
| CRP plasmatic> 150 mg/L și | |||||
| TAP urinar> 35 nmol/L | 74 | 85 | 58 | 92 | 83 |
| APACHE II ≥ 8 | 56 | 64 | 30 | 85 | 63 |
| Scorul Imrie ≥ 3 | 77 | 75 | 44 | 93 | 76 |
| Scorul Ranson ≥ 3 | 89 | 64 | 38 | 96 | 69 |
PPV = valoare predictivă pozitivă; VAN = valoare predictivă negativă.
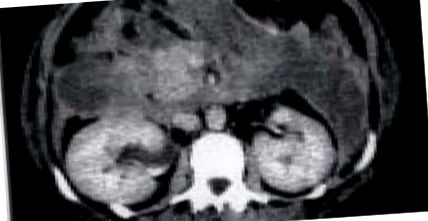
Tomografia computerizată intravenoasă cu contrast îmbunătățit (CE-CT) a fost, de asemenea, utilizată pentru a prezice severitatea unui atac de pancreatită acută [19]. Balthazar a descris un indice de severitate a CT, bazat pe o combinație de inflamație peripancreatică și gradul de necroză pancreatică, așa cum s-a observat la studiul CT inițial. Pacienții cu un indice de severitate CT ridicat au avut 92% morbiditate și 17% mortalitate; pacienții cu un indice de gravitate scăzut al CT au avut morbiditate de 2% și niciunul nu a murit [20]. Acest tip de sistem de notare care utilizează CT nu oferă avantaje în comparație cu sistemele de notare clinico-biochimice pentru predicția bolii severe [21]. Mai degrabă valoarea CE-CT se află în detectarea necrozei pancreatice și definirea întinderii și distribuției sale (Figura (Figura 1 1)] [22-25], precum și în ajutarea la delimitarea oricăror colecții asociate [26]. permit, de asemenea, urmărirea progresiei bolii și sunt un adjuvant esențial atunci când este necesară intervenția chirurgicală.
Necroză pancreatică retroperitoneală extinsă.
DETECTAREA INFECȚIEI
În plus față de cantitatea de necroză pancreatică, rezultatul pancreatitei severe este, de asemenea, determinat de prezența sau absența infecției în țesutul necrotic [27]. Indicatorii clinici care sugerează prezența infecției includ pirexia, hipotensiunea, tahicardia continuă și leucocitoza, dar aceste caracteristici ale sindromului sepsis sunt identice cu cele la pacienții cu pancreatită severă, indiferent de prezența infecției pancreatice [28]. Beger și colab. [29] au studiat 144 de pacienți cărora li s-a făcut necrosectomie deschisă. Proporția pacienților care aveau o contaminare bacteriană demonstrabilă în momentul necrosectomiei a crescut de la 24% în prima săptămână la 36% în a doua și a atins un maxim de 72% în a treia săptămână, sugerând că infecția nu este imediată, dar că frecvența acesteia crește cu timpul . Tabelul Tabelul 2 2 prezintă organismele găsite în pancreasul necrotic infectat în studiul lor, care a fost realizat înainte de utilizarea de rutină a antibioticelor profilactice. Profilul organismelor infectante sugerează originea din tractul gastro-intestinal.
masa 2
Bacterii izolate din specimene operatorii luate la necrosectomie înainte de introducerea profilaxiei antibiotice de rutină, Beger și colab. [29], 1986
| Bacterii izolate | Nu. de pacienți |
| Gram - și aerobic | |
| Escherichia coli | 24 |
| Enterobacter aerogenes | 16 |
| Pseudomonas aeruginosa | 5 |
| Specie Proteus | 5 |
| Pneumonie Klebsiella | 3 |
| Prietenii Citrobacter | 1 |
| Gram - și anaerob | |
| Specii bacteroide | 5 |
| Gram + ve aerobic | |
| Streptococcus faecalis | 6 |
| Staphlococcus aureus | 4 |
| Streptococcus viridans | 1 |
| Staplococcis epidermidis | 1 |
| Alții | |
| Mycobacterium tuberculosis | 1 |
| Specii candida | 3 |
Mai multe studii au arătat că CRP persistent crescut este asociat cu necroză pancreatică infectată [30]. Prezența gazului într-o zonă de necroză arătată de CE-CT este foarte sugestivă pentru infecție (Figura (Figura 2), 2), deși este de dorit să se detecteze prezența infecției înainte ca aceasta să devină evidentă. Cu toate acestea, aspirația cu ac fin ghidat CE-CT permite prelevarea directă a țesutului necrotic și microscopia ulterioară și bacteriologia (FNAB) vor confirma prezența organismelor infectante (Figura (Figura 3)) [31,32].
Infecția necrozei pancreatice cu organisme care formează gaze.
- Cauze și gestionare a hiperacidității
- Sănătate Fitness Util Ce este o revizuire a taliei Pastile dietetice - Managementul HazMat
- Obezitate hipotalamică Obstinată rezistență la gestionarea obezității Godse C, Vaidya RA - J Obes Metab
- Managementul facilităților medicale, servicii de luat masa și servicii pentru pacienți
- Scrisoare de îngrijorare Ghidul OMS pentru gestionarea supraponderalității și obezității în ENN din copilărie