Abstract
fundal
Sindromul Liddle este o boală monogenă cu moștenire autozomală dominantă. Caracteristicile de bază ale acestei boli sunt hipertensiunea, concentrația redusă de aldosteron și activitatea reninei, precum și creșterea excreției de potasiu ducând la niveluri scăzute de potasiu în ser și alcaloză metabolică. Cauza sindromului Liddle este mutația în sens sau în schimbarea cadrului SCNN1A, SCNN1B, sau SCNN1G gene care codifică subunitățile canalului de sodiu epitelial.
Prezentarea cazului
Descriem o familie cu sindrom Liddle din Rusia. Probandul de 15 ani are hipertensiune arterială, hipokaliemie, hiporeninemie, alcaloză metabolică, dar nivelul aldosteronului se încadrează în intervalul normal. La vârsta de 12 ani, hipertensiunea arterială a fost observată pentru prima dată. Am identificat o nouă mutație framehift c.1769delG (p.Gly590Alafs) în SCNN1G, care codifică γ subunitate a ENaC la vertebrate. Tatăl și sora mai mică găzduiesc, de asemenea, această ștergere heterozigotă. Tratamentul cu amiloridă al probandului și sorei sale nu a normalizat tensiunea arterială, ci a normalizat nivelul activității reninei plasmatice.
Concluzii
Rezultatele noastre extind spectrul mutațional al sindromului Liddle și oferă dovezi suplimentare că motivul PY conservat este crucial pentru controlul activității ENaC. Analiza genetică are implicații pentru gestionarea hipertensiunii arteriale, tratamentul specific cu amilorid și consilierea în familiile cu sindrom Liddle.
fundal
Sindromul Liddle (pseudoaldosteronism, OMIM 177200; 618,114; 618,126) este o tulburare genetică eterogenă autosomală dominantă. Caracteristicile clinice cheie ale acestui sindrom sunt hipertensiunea sensibilă la sare cu debut precoce cu niveluri scăzute de K +, alcaloza metabolică, inhibarea activității reninei și secreția de aldosteron [1].
Mutațiile (sensul sau schimbarea cadrelor) în genele subunităților canalului de sodiu epitelial (ENaC) provoacă sindromul Liddle. Aceste canale aparțin familiei ENaC/DEG (degenerin) a canalelor de cationi protonate. ENaC mediază transportul Na + prin membrana apicală din lumen în celula epitelială [2]. Deoarece ENaC reglează echilibrul ionic Na + în fluidul extracelular (ECF) și în rinichi, aceste canale reprezintă o parte semnificativă a volumului ECF și a reglării tensiunii arteriale (TA) [3].
Canalele ENaC sunt prezente în porțiunea apicală a celulelor epiteliale ale nefronului distal, colonului distal, plămânului și canalelor glandelor exocrine. Canalul este format din trei subunități codificate de trei gene: α (SCNN1A), β (SCNN1B) și γ (SCNN1G). Toate subunitățile au o structură similară: N-terminal citoplasmatic, buclă extracelulară, două segmente hidrofobe scurte (domeniile transmembranare 1 și 2) și C-terminal citoplasmatic. Termenii N și C sunt îndreptați către suprafața citosolică, în timp ce bucla extracelulară este îndreptată către suprafața extracelulară [4]. Capătul C-terminal al tuturor subunităților ENaC are o secvență foarte conservată - motiv PY (Proline Tyrosine) [5]. Studiile de eliminare a genelor care inactivează genele subunităților ENaC la șoareci au demonstrat că toate cele trei subunități sunt semnificative pentru supraviețuire. Șoarecii knockout fără nicio subunitate ENaC mor din cauza insuficienței respiratorii sau a disfuncției renale [6, 7]. Simptome similare au fost observate la om cu pseudohipaldosteronism de tip 1 (OMIM 264350). Această boală se dezvoltă dacă pacientul are două copii mutante ale uneia dintre genele subunităților ENaC și este alelic la sindromul Liddle [8].
Sindromul Liddle este asociat cu mutații ale liniei germinale într-o alelă a SCNN1A, SCNN1B sau SCNN1G gene [9]. Aceste gene sunt localizate pe diferiți cromozomi: SCNN1A este pe cromozomul 12p13.31, SCNN1B și SCNN1G sunt pe cromozomul 16p12.2 [4]. Cele mai multe mutații au fost găsite în SCNN1B și SCNN1G gene. Mutația unică a fost raportată în genă SCNN1A: Salih și colab. a descris o mutație heterozigotă în sens extracelular al subunității α a ENaC ca fiind cauza sindromului Liddle [10]. Variante patogene în SCNN1B și SCNN1G eliminați sau modificați motivele intracelulare Proline-Tyrosine din ENaC [9].
Aici, descriem o familie rusă care suferă de sindromul Liddle din cauza mutației framehift în SCNN1G genă.
Prezentarea cazului
Descriem o familie rusă cu sindrom Liddle: proband, mama, tatăl și sora lui. Mai jos este o descriere detaliată a caracteristicilor clinice ale probandului și ale surorii sale. Caracteristicile biochimice de bază ale acestor pacienți sunt rezumate în Tabelul 1.
Proband este un bărbat de 15 ani din Republica Rusă Dagestan. S-a născut din a doua sarcină și a doua naștere a unor părinți sănătoși neconsanguini. Greutatea sa la naștere a fost de 3500 g. Perioada neonatală a fost fără evenimente. A crescut și s-a dezvoltat în funcție de vârsta sa.
În timpul activităților sportive la vârsta de 12 ani, s-a constatat pentru prima dată hipertensiune arterială. De la 13,5 ani, pacientul se plânge de dureri de cap și dispnee în timpul exercițiului. TA a fost stabilă la 160/100 mmHg. Au fost relevate hipertrofia miocardului ventricular stâng și angiopatia vaselor retiniene. Nivelul plasmatic al hormonilor tiroidieni, ACTH (hormon adrenocorticotrop), cortizol, dehidroepiandrosteron, aldosteron (23 pg/ml, interval normal 10-160 pg/ml), adrenalină, noradrenalină, dopamină și serotonină a fost normal. Nivelul de urină al metanefrinelor a fost normal. Nivelul seric al activității reninei a fost redus la 0,1 ng/ml/h (interval normal 1,2-2,4 ng/ml/h). Tratamentul cu Lisinopril (inhibitor al enzimei de conversie a angiotensinei, ECA) și Amlodipină (blocant al canalelor de calciu angioselective) a fost ineficient.
A fost admis la Veltischev Research and Clinical Institute for Pediatrics al Pirogov Russian National Research Medical University (Moscova, Rusia) la 14, 15 și 16 ani.
La internare la 14 ani a avut TA mare (160/120 mmHg), nivel redus de potasiu (3,4 mmol/L, interval normal 3,7-5,12 mmol/L) și activitate renină (0,5 ng/mL/h). Ecografia nu a prezentat nicio anomalie a rinichilor. Tratamentul cu Amlodipină și Bisoprolol (beta-blocant) nu a normalizat hipertensiunea.
Pe parcursul unui an, pacientul a primit Irbesartan, Amlodipină, Bisoprolol și Moxonidină. Dar hipertensiunea arterială a persistat.
La admitere la 15 ani, greutatea sa era de 70 kg, înălțimea de 175 cm. Dezvoltarea intelectuală a corespuns vârstei sale. TA maximă a fost de 159/109 mmHg. Ritmul cardiac în timp ce stătea culcat era de 66 bpm, ritmul cardiac în picioare era de 76 bpm. Inima nu a fost mărită; sunetele inimii erau clare și ritmice. Analiza biochimică a arătat niveluri reduse de potasiu (3,4 mmol/L), activitate redusă a reninei (0,1 ng/ml/h), niveluri crescute de lactat dehidrogenază (LDH, 479 U/L, interval normal 0-450 U/L) și creatină kinază (CK, 317 U/L, interval normal 15–190 U/L). Echilibrul acido-bazic este deplasat spre alcaloză metabolică: pH 7,45, BE (exces de bază) + 7,4 mmol/L, HCO3 std. 31 mmol/L. Alți parametri biochimici (niveluri de sodiu, creatinină și altele), precum și nivelul aldosteronului (88.968 pg/ml), profilul hormonal al glandei tiroide și indicatorii cardiaci au fost în intervalul normal. Analiza urinei a fost fără modificări semnificative.
Ecocardiografia a arătat hipertrofie ventriculară stângă concentrică, insuficiență valvulară tricuspidă și mitrală. Funcțiile miocardice sistolice și diastolice globale nu au fost anormale. Monitorizarea zilnică a TA a arătat hipertensiune arterială sistolică și diastolică stabilă în timpul nopții și în timpul zilei. Ecografia abdominală nu a relevat modificări semnificative.
Datorită prezenței hipertensiunii arteriale, a hipokaliemiei, a hiporeninemiei și a alcalozei metabolice, a fost de așteptat la pacient o formă monogenă de hipertensiune arterială. Diagnosticul diferențial a fost efectuat între două afecțiuni: sindromul Liddle și sindromul aparent în exces de mineralocorticoizi.
Sora mai mică (14 ani, 46 kg, 162 cm) de proband avea TA normală (120/80 mmHg) cu o creștere periodică la 160/100 mmHg. De 12 ani, ea se plânge de dureri de cap și greață dimineața. A avut un nivel seric redus de aldosteron (9,7 pg/ml), activitate redusă a reninei (1,01 ng/ml/h) și niveluri normale de potasiu (4,0 mmol/L). Nivelul de sodiu (141 mmol/L) și cortizol (12,5 mcg/dL) s-a situat în intervalul normal. Nu au existat semne de alcaloză metabolică în sângele surorii (pH 7,4; BE - 3,4 mmol/L, HCO3 std. 22 mmol/L). Analiza urinei a fost fără modificări semnificative. Ecocardiografia a arătat hipertrofie ventriculară stângă simetrică.
Tatăl proband (47 de ani) a avut, de asemenea, hipertensiune arterială (TA 170/120 mmHg cu creștere periodică la 210/140 mmHg) de la vârsta de 18 ani. Ecografia a prezentat chisturi renale. Este imposibil să se descrie simptomele clinice detaliate ale tatălui din cauza refuzului acestuia de a fi supus unui examen și tratament.
ADN-ul genomic a fost extras din probe de sânge periferic de proband, mama, tatăl și sora mai mică.
Secvențierea genelor relevante clinic (exomul clinic) a fost realizată de Genotek Ltd. Comitetul de etică al Genotek (08/2018) a aprobat toate studiile. Părinții și-au dat consimțământul scris în scris pentru cercetarea și publicarea fotografiilor, a datelor clinice și a secvențializării lor, a proband și a surorii sale.
Kitul de pregătire NEBNext Ultra DNA Library pentru Illumina (New England Biolabs, MA, SUA) a fost utilizat ca reactiv pentru prepararea bibliotecilor de ADN. Îmbogățirea țintei a fost realizată cu sistemul SureSelect XT2 (Agilent Technologies, CA, SUA). Următoarele eșantioane au fost secvențiate pe Illumina HiSeq 2500 (citire de 100 bp-end). Pentru a tăia 3'-nucleotide, am folosit Cutadapt [11]. Citirile au fost aliniate la GRCh37.p13 cu BWA MEM [12]. A fost efectuată analiza citirilor cu FASTQS pentru controlul calității [13]. Am numit variante scurte folosind GATK HaplotypeCaller [14] în concordanță cu cele mai bune practici GATK DNA-seq [15, 16]. Efectele variantei au fost evaluate de snpEff [17]. Pentru a estima patogenitatea, informațiile au fost preluate din bazele de date dbNSFP [18], Clinvar [19], OMIM [20] și HGMD [21]. Limitările instrumentelor de predicție in silico - SIFT și PolyPhen-2 - nu ne-au permis să folosim aceste instrumente pentru acest tip de mutații. Frecvențele alele mutante au fost extrase din bazele de date 1000Genomes [22], ExAC [23] și Genotek. Patogenitatea a fost evaluată în conformitate cu recomandările internaționale: ACMG (Colegiul American de Genetică Medicală și Genomică), CAP (Colegiul Patologilor Americani), AMP (Asociația pentru Patologie Moleculară) [24].
Toți exonii genelor SCNN1A, SCNN1B și SCNN1G au fost secvențați. Un fișier de tabel suplimentar prezintă alte gene și exoni care au fost secvențați [a se vedea fișierul suplimentar 1].
SCNN1G varianta patogenă a fost identificată la proband și rudele sale folosind secvențierea exomului (exomul clinic) și apoi a fost verificată prin secvențierea Sanger.
După secvențierea exomei, probandul și sora lui au început să ia amiloridă (cu hidroclorotiazidă) și o dietă săracă în săruri.
O doză de 5 mg amiloridă/50 mg hidroclorotiazidă a provocat reacții adverse severe (slăbiciune, oboseală) la proband. Doza de medicament a fost redusă la 2,5 mg amiloridă/25 mg hidroclorotiazidă. După 6 luni de terapie, TA de proband nu s-a normalizat cu o creștere maximă la 160/110. De asemenea, au fost relevate niveluri ridicate de homocisteină (20,5 μmol/L, interval normal de 5-12 μmol/L). Alți parametri biochimici, precum și nivelurile de activitate ale aldosteronului și reninei au fost în intervalul normal. Cu toate acestea, ultrasunetele au relevat modificări difuze ale parenchimului renal.
O doză de 5 mg de amiloridă/50 mg de hidroclorotiazidă a determinat o creștere a nivelurilor de creatină până la 85 μmol/L la sora probandului. Doza de medicament a fost redusă la 2,5 mg amiloridă/25 mg hidroclorotiazidă. După 6 luni de terapie, TA sora a avut tendința de a se normaliza cu o creștere maximă la 141/98. Alți parametri biochimici, precum și nivelurile de activitate ale aldosteronului și reninei au fost în intervalul normal. Cu toate acestea, ultrasunetele au relevat o creștere a volumului și îngroșarea parenchimului renal.
discutii si concluzii
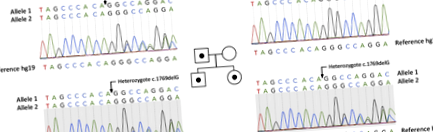
Am dezvăluit o nouă mutație heterozigotă c.1769delG (p.Gly590Alafs) din SCNN1G (NM_001039.3) prin analiza NGS și confirmat prin secvențierea Sanger. Am identificat această mutație în probe de proband, tatăl și sora lui. Nu a existat nicio mutație a SCNN1G la mamă (Fig. 1).
Pedigree al unei familii cu sindrom Liddle. Pătrate și cercuri reprezintă bărbați și, respectiv, femele. Persoanele cu mutația p.Gly590fs sunt prezentate ca simboluri umplute. Persoanele lipsite de mutație sunt prezentate ca simboluri deschise
De asemenea, am descoperit că proband, mama și sora lui au mutație heterozigotă în sens DSG2 gena: c.458A> G, p.Asn153Ser (NM_001943.3). Conform recomandării ACMG, această mutație este considerată a fi probabil patogenă. Mutațiile din această genă sunt considerate a provoca displazie aritmogenă (ventriculară dreaptă) (OMIM 610193). Nu au fost găsite alte variante patogene și SNV.
Mutația c.1769delG este ștergerea în exonul 13 care a mutat un cadru de citire. Mutalizatorul [25] prezice că această variantă duce la îndepărtarea aminoacizilor de la 590 la 649 și înlocuirea acestora cu o succesiune scurtă de 8 aminoacizi (Fig. 2). Această secvență se încheie cu codon stop. Conform recomandării ACMG, mutația c.1769delG este considerată a fi probabil patogenă. Această mutație nu a fost raportată niciodată în literatură și în bazele de date (inclusiv ExaC și 1000 Genomes). De asemenea, varianta c.1769delG nu a fost detectată la 2000 de pacienți din baza de date Genotek.
Predicția modificărilor subunității γ a canalului ENaC datorită mutației c.1769delG a SCNN1G
Mutații heterocigote în SCNN1G poate duce la sindromul Liddle. Până în prezent, 6 mutații diferite ale SCNN1G au fost raportate în 8 familii din Finlanda, China și Japonia [26,27,28,29,30,31,32] (Tabelul 2).
Majoritatea mutațiilor descrise elimină un segment bogat în prolină (motiv Proline-Tyrosine, PPPxY) în coada citoplasmatică carboxilică a subunității γ (624 PPPKY 628). Acest segment este angajat în reglarea negativă a canalului și supraactivarea acestuia [5]. PPPxY, servește ca regiune pentru conectarea Nedd4 (celula precursorului neuronal exprimat proteina 4 reglată în jos de dezvoltare). Această enzimă este ubiquitin-proteina ligază și este implicată în internalizarea și degradarea proteazomală a ENaC [33]. Îndepărtarea PPPxY inhibă internalizarea și degradarea canalului utilizând calea de omniprezentare-proteazomală. De asemenea, aceasta duce la acumularea de ENaC în membrana apicală nefronică distală, care la rândul său crește reabsorbția de sodiu [4].
Rezultatul mutației p.Gly590Alafs este scurtarea capătului C-terminal al γ ENaC cu absența motivului PY. Terminarea are loc mai departe de-a lungul secvenței de aminoacizi decât în toate cazurile descrise (Tabelul 2). Acest lucru ne permite să reducem limita pentru scurtarea critică a subunității γ pentru sindromul Liddle. Hansson și colab. a raportat mutația p.Trp574Ter în familia japoneză cu sindrom Liddle [30]. Conform Genome Browser [34] regiunea între 574 și 590 aminoacizi este neconservativă. Este puțin probabil ca mutațiile cu sens greșit care schimbă această regiune să aibă un impact mare asupra funcției proteinelor. Mutațiile care conduc la oprirea prematură a sintezei proteinelor cu îndepărtarea motivului PY determină o funcție a canalului de schimbare. Mutația descoperită de noi oferă o dovadă mai mare că îndepărtarea motivului PY conservat este crucială pentru funcționarea subunităților ENaC.
Folosind analiza secvențierii ADN, am diagnosticat probandul și familia acestuia. Permeabilitatea membranelor celulare pentru sodiu este semnificativ crescută la pacienții cu sindrom Liddle. Rinichii acestor pacienți sunt în stare ca și cum ar fi consumat și ar păstra cantități excesive de sare, iar o dietă cu conținut scăzut de sare este o parte semnificativă a terapiei [35]. Pentru tratamentul acestui sindrom, sunt necesare diuretice care economisesc potasiu, cum ar fi amilorida și triamterenul. Amilorida și triamterenul acționează prin blocarea precisă a ENaC. Terapia sindromului Liddle cu amiloridă sau triamteren reduce TA, precum și corectează hipokaliemia și alcaloza. Amiloride a fost prescris lui Proband și surorii sale. Tatăl a refuzat tratamentul. Tratamentul cu amilorid nu a dus la normalizarea TA, dar activitatea reninei plasmatice a atins un nivel normal.
Fenotipul clasic al sindromului Liddle se caracterizează prin hipertensiune arterială severă și hipokaliemie, dar această boală poate fi clinic eterogenă. Pacienții pot avea TA mare, fără alte simptome. Testarea genetică împreună cu studii hormonale pot ajuta la depistarea precoce a hipertensiunii arteriale monogene. În cazul nostru, identificarea SCNN1G mutația a permis începerea terapiei surorii mai mici înainte de dezvoltarea hipertensiunii rezistente și a modificărilor patologice în inimă. TA după tratamentul cu amiloridă tinde să se normalizeze.
Există mai multe forme de hipertensiune monogenică: sindrom Liddle, aldosteronism remediabil cu glucocorticoizi, sindrom Gordon, exces aparent de mineralocorticoizi, hiperplazie suprarenală congenitală. Aproape toate aceste forme se caracterizează prin deteriorarea transportului electroliților în nefronul distal sau prin sinteza sau activitatea hormonilor mineralocorticoizi [36].
Definirea bazei moleculare a sindromului Liddle este utilă pentru diagnosticarea precoce, înțelegerea fiziopatologiei bolii și selectarea terapiei personalizate. Dificultatea identificării formelor monogene de hipertensiune crește frecvența diagnosticului greșit. Diagnosticul greșit și tratamentul incorect pot provoca accident vascular cerebral cu debut precoce, stadiul terminal al insuficienței renale, infarctul miocardic și moartea subită.
Pe scurt, am descris o familie care suferă de sindromul Liddle cauzată de o nouă mutație framehift (c.1769delG) în gena care codifică subunitatea γ a canalului de sodiu epitelial.
Disponibilitatea datelor și a materialelor
Nu am folosit software, baze de date sau aplicații/instrumente noi în articol. Seturile de date utilizate și/sau analizate în timpul studiului actual sunt disponibile de la autorul corespunzător, la o cerere rezonabilă.
- Boala de depozitare a glicogenului cu debut tardiv tip II (boala Pompe) cu o mutație nouă A malaeziană
- Sindromul de activare a mastocitelor (partea 3) Rolul nutriției și stresului - Pentru o pace digestivă a
- Sindromul de activare a celulelor mast - Ce este și ce nu este; Gastro practic
- Beneficiile pentru sănătate ale varzei - Grădinărit
- Beneficiile pentru sănătate ale nectarinului - Canal de grădinărit