Abstract
Scopuri/ipoteze
Coactivatorul transcripțional al receptorului activat cu proliferatorul peroxizomului-γ coactivatorul-1α (PGC-1α) îmbunătățește căile relevante din punct de vedere metabolic, cum ar fi gluconeogeneza, oxidarea acizilor grași, termogeneza, fosforilarea oxidativă și biogeneza mitocondrială. Deoarece reglarea expresiei genei care codifică PGC-1α (PPARGC1A) prin nutrienți/metaboliți nu a fost evaluat în detaliu, scopul acestui studiu a fost de a determina dacă PPARGC1A (și PPARGC1B) expresia este modulată de acizi grași de plasmă obișnuiți în celulele musculare scheletice umane.
Metode
Miotuburile umane care fuseseră diferențiate in vitro au fost tratate cu miristat de 0,5 mmol/l (C14: 0), palmitat (C16: 0), stearat (C18: 0), palmitoleat (C16: 1-7), oleat (C18: 1ω9) sau linoleat (C18: 2ω6). PPARGC1A/B ARNm a fost cuantificat prin RT-PCR. Activitatea mitocondrială a fost determinată de formarea formazanului.
Rezultate
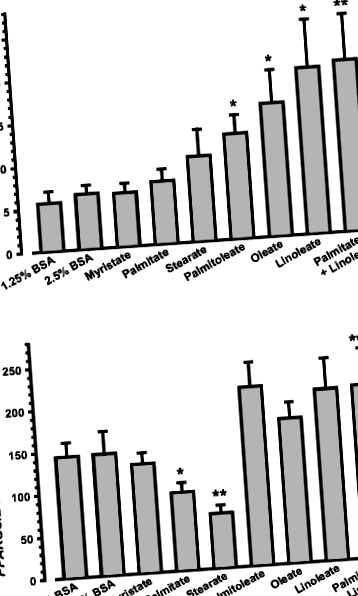
Celulele netratate au exprimat de 28 de ori mai mult PPARGC1B mARN decât PPARGC1A ARNm (13,33 ± 2,86 vs 0,47 ± 0,08 fg/μg ARN total, n= 5). PPARGC1A expresia a fost crescută de două până la trei ori de către toți acizii grași nesaturați (UFA) testațip
Introducere
PGC-1β, omologul structural cel mai apropiat de PGC-1α, este codificat de o genă separată și prezintă o distribuție tisulară similară. Rolul jucat de PGC-1β nu este bine înțeles, dar o suprapunere funcțională semnificativă cu PGC-1α este sugerată de faptul că ambele proteine sunt, cel puțin parțial, capabile să coactiveze aceiași factori de transcripție și să inducă expresia unui set similar de gene țintă. Cu toate acestea, descoperirile noi la gemeni indică, de asemenea, diferențe funcționale, PGC-1β fiind mai importantă în β-oxidarea mitocondrială [4].
Datele privind reglarea acestor doi coactivatori transcripționali de către nutrienți și metaboliți sunt rare. Astfel, scopul acestui studiu a fost de a determina dacă NEFA-urile comune din plasmă, care sunt fie derivate din dietă, fie sunt eliberate lipolitic din depozitele de trigliceride, modulează expresia PPARGC1A și PPARGC1B in celulele musculare scheletice umane in vitro.
Subiecte, materiale și metode
Cultură de celule
Celulele musculare scheletice primare umane au fost obținute din biopsiile cu ac ale mușchiului vastus lateralis și crescute și diferențiate, așa cum s-a descris anterior [5]. În ziua 5 de diferențiere, celulele au fost tratate fie cu BSA fără acizi grași (Sigma-Aldrich, Taufkirchen, Germania), ca martor, fie cu 0,5 mmol/l NEFA (Sigma-Aldrich) legat de BSA. Soluții stoc (8 mmol/l) de mirat (C14: 0), palmitat (C16: 0), palmitoleat (C16: 1ω7), oleat (C18: 1ω9) și linoleat (C18: 2ω6) și un 4-mmol/S-au preparat soluție stoc de stearat (C18: 0) în tampon Krebs - Ringer - HEPES conținând 20% BSA prin agitare peste noapte la 37 ° C sub azot. Donatorii de celule musculare au fost recrutați din studiul familiei Tuebingen pentru diabetul de tip 2 și au dat consimțământul scris în cunoștință de cauză studiului. Studiul a fost aprobat de comitetul etic local.
RT-PCR în timp real
Celulele au fost tratate timp de 20 de ore, apoi spălate și recoltate prin tripsinizare. ARN-ul a fost izolat cu coloane RNeasy (Qiagen, Hilden, Germania). ARN total tratat cu DNază I fără RNază a fost transcris în ADNc folosind transcriptaza inversă AMV și trusa de sinteză a ADN-ului First Strand de la Roche Diagnostics (Mannheim, Germania). PCR cantitativă a fost efectuată în triplicat cu SYBR Green pe un LightCycler (Roche Diagnostics) folosind următorii primeri (Invitrogen, Karlsruhe, Germania): PPARGC1A: înainte 5'-TGTGCAACTCTCTGGAACTG-3 ', invers 5'-TGAGGACTTGCTGAGTGGTG-3'; PPARGC1B: înainte 5'-GCTCTCCTCCTTCTTCCTCA-3 ', invers 5'-ATAGAGCGTCTCCACCATCC-3'; ARNr 28S: înainte 5'-ACGGCGGGAGTAACTATGACT-3 ', invers 5'-CTTGGCTGTGGTTTCGCT-3'. Condițiile PCR au fost următoarele: PPARGC1A ARNm: temperatura de recoacere 65 ° C, 45 cicluri; PPARGC1B ARNm: temperatura de recoacere 68 ° C, 45 cicluri; 28S temperatura de recoacere a ARNr 63 ° C, 50 cicluri (MgCl2 în toate reacțiile 4 mmol/l).
Determinarea activității mitocondriale
După tratament, celulele cultivate în duplicat au fost incubate timp de 4 ore cu 0,5 mg/ml bromură de 3- (4,5-dimetiltiazol-2-il) -2,5-difenil tetrazoliu (MTT) înainte de liza peste noapte prin adăugarea a două volume de 10% SDS în 0,01 mol/l HCI. A fost utilizat kitul de proliferare celulară I (MTT) de la Roche Diagnostics. Lizatele au fost transferate în tuburi, agitate și apoi colorantul formazan produs de dehidrogenazele mitocondriale a fost măsurat fotometric la 565 nm.
Rezultate
Miotuburile umane diferențiate in vitro netratate au exprimat niveluri scăzute, dar detectabile în mod constant PPARGC1A ARNm (0,47 ± 0,08 fg/μg ARN total, n= 5). Nivele de PPARGC1B ARNm au fost de 28 de ori mai mari în aceleași celule (13,33 ± 2,86 fg/μg ARN total, n= 5).
Tratamentul cu BSA (control), un singur NEFA (0,5 mmol/l) sau o combinație de palmitat și linoleat timp de 20 de ore nu a modificat conținutul de ARNr 28S celular sau viabilitatea celularăn= 5, datele nu sunt afișate); astfel, s-a utilizat ARNr 28S pentru normalizare. Nivele de PPARGC1A mARN-urile au fost de două până la trei ori mai mari în celulele tratate cu palmitoleat de NEFA nesaturate (UFA) (p= 0,0282, n= 5), oleatp= 0,0412, n= 5) sau linoleatp= 0,0432, n= 5) decât în celulele de control (Fig. 1a). Cu toate acestea, tratamentul cu miristat, palmitat sau stearat al NEFA saturate (SFA) nu a modulat PPARGC1A Nivelurile de ARNm (Fig. 1a, n= 5). Coincubarea miotuburilor cu palmitat și linoleat a arătat că palmitatul nu a putut bloca efectul stimulator al linoleatului asupra PPARGC1A expresie (Fig. 1a).
În schimb, celular PPARGC1B Conținutul de ARNm nu a fost crescut prin tratamentul cu UFA sau SFA (Fig. 1b, n= 5). Cu toate acestea, comparativ cu cel din celulele de control, expresia PPARGC1B ARNm a fost reglat în jos de palmitatul SFA (p= 0,0356, n= 5) și stearatp= 0,0235, n= 5) cu 35 și respectiv 55% (Fig. 1b). Coincubarea miotuburilor cu palmitat și linoleat a dus la inversarea completă a efectului inhibitor al palmitatului asupra PGC-1β (Fig. 1b; p= 0,0340 pentru palmitat vs. palmitat + linoleat, n= 5).
Deoarece modularea PPARGC1A și PPARGC1B exprimarea este de așteptat să influențeze activitatea mitocondrială, am efectuat un test MTT pentru a determina activitatea dehidrogenazei mitocondriale. Incubația cu stearat timp de 20 de ore a redus semnificativ formarea formazanului (Fig. 2; p= 0,0003 vs control, n= 5), în timp ce miristatul și palmitatul SFA nu au avut niciun efect. Activitatea mitocondrială a crescut ca răspuns la tratamentul cu palmitoleat de UFA (p FIG. 2
Discuţie
Studii recente la om au demonstrat că perfuzia lipidică reglează în jos mușchii PPARGC1A expresia [6], în timp ce intervenția cu acid nicotinic suprimă nivelurile plasmatice de NEFA și crește concomitent mușchii PPARGC1A ARNm [7]. Cu toate acestea, nu s-a stabilit dacă a fost modificat PPARGC1A expresia este cauzată direct de modificările concentrațiilor plasmatice de NEFA. Arătăm aici că tratamentul miotuburilor umane cu specii NEFA unice la concentrații ridicate, dar fiziologice, au produs un model unic de reglare a expresiei genelor care codifică isoformele PGC-1: UFA cresc PPARGC1A expresie, dar nu au niciun impact asupra reglementării PPARGC1B expresie; pe de altă parte, SFA-urile reglementează în jos PPARGC1B expresie dar nu modulează PPARGC1A expresie. Cum au efectele acestor NEFA asupra mușchilor PPARGC1A/B expresia mediată este încă necunoscută, dar este de conceput că factorii de transcripție activați de NEFA, cum ar fi PPAR, joacă un rol.
Mai mult, am tratat miotuburile cu o combinație de linoleat și palmitat. Efectul stimulator al linoleatului UFA asupra PPARGC1A expresia nu a fost antagonizată de palmitatul SFA. Această observație este în concordanță cu datele obținute în insulele izolate de șobolani, unde un amestec UFA/SFA (oleat/palmitat) a crescut, de asemenea. PPARGC1A expresie mARN [8]. Motivele pentru care aceste date nu reflectă rezultatele studiilor de intervenție [6, 7] sunt neclare, dar ar putea fi explicate prin efectele secundare ale manipulărilor in vivo. În special, impactul inhibitor al palmitatului asupra miotubului PPARGC1B expresia a fost complet inversată de linoleat. Astfel, descoperirile noastre sugerează că UFA nu numai că exercită efecte benefice directe asupra metabolismului celular al glucozei/lipidelor prin PGC-1α, ci și protejează împotriva efectelor metabolice dăunătoare ale SFA la nivelul PGC-1β.
Un tipar diferit de reglare a expresiei genelor care codifică izoforma PGC-1 a fost raportat la hepatocitele murine primare [9]: nici una dintre izoforme nu a fost reglată în jos de niciunul dintre NEFA testate; Ppargcla a fost indusă numai de stearat, în timp ce Ppargclb a fost indusă de UFA și de SFA. Aceste rezultate divergente ar putea reflecta reglarea specifică țesutului a genelor care codifică cele două izoforme, așa cum sa arătat deja in vivo: în stările diabetice de tip 2, PPARGC1A expresia este scăzută la nivelul mușchilor scheletici [2, 3] și crescută la nivelul ficatului [10].
De asemenea, am evaluat dacă modificările din myotube PPARGC1A/B expresia au fost însoțite de modificări ale activității mitocondriale, indicând relevanță biologică. UFA au stimulat activitatea dehidrogenazelor mitocondriale, în timp ce stearatul SFA a scăzut activitatea lor. Aceste observații pot fi explicate prin transactivarea îmbunătățită și, respectiv, atenuată a NRF-1. Spre deosebire de stearat, palmitatul nu a fost inhibitor. Acest lucru s-ar putea datora compensării funcționale a efectului său represiv slab asupra PPARGC1B expresie (comparată cu cea a stearatului) prin tendința sa concomitentă de stimulare PPARGC1A expresie.
Cele două căi majore cunoscute pentru promovare PPARGC1A expresia în mușchiul scheletic sunt cAMP-proteina kinaza A și axele calcineurin-calciu-calmodulin-dependente ale protein kinazei IV (pentru recenzie, vezi [1]). Am testat dacă mediile UFA mediază PPARGC1A inducerea în miotuburile umane prin una dintre aceste căi. Cu toate acestea, nu am detectat formarea AMPc după stimulare cu oricare dintre NEFA testate. Mai mult, blocarea protein kinazei A și calcineurinei (folosind H-89 și respectiv ciclosporina A) a dezvăluit că această cale nu este implicată. Astfel, trebuie să existe alte căi mediate de UFA care promovează PPARGC1A expresie.
În concluzie, în prezentul studiu am demonstrat reglarea diferențială a PPARGC1A și PPARGC1B expresie de către NEFA: UFA stimulează PPARGC1A expresie, în timp ce SFA-urile reprimă PPARGC1B expresie. Deși conținutul absolut de mRNA isoform PGC-1 al miotuburilor umane nu reflectă nivelurile de expresie observate în biopsiile musculare native umane (unde PPARGC1A este la fel [4] sau mai mult [3] abundent decât PPARGC1B) și sunt prezentate doar datele ARNm, presupunem că NEFA joacă un rol important în reglarea oxidării acizilor grași musculari și a fosforilării oxidative.
Abrevieri
Bromură de 3- (4,5-dimetiltiazol-2-il) -2,5-difenil tetrazoliu
- Exprimarea genelor selectate care codifică căi mecaniciste, transportori de nutrienți și aminoacizi în
- Efectul liniei genetice și a dietelor mixte îmbogățite cu acid oleic asupra acidului gras subcutanat
- Articolul complet Eficacitatea intervențiilor stilului de viață în NAFLD (boală hepatică grasă nealcoolică)
- Depresie la pacienții cu boală hepatică grasă nealcoolică și hepatită virală cronică B și C -
- Efectele dietei occidentale asupra giardiozei Un rol pentru acizii grași și microbiota intestinală în persistență