Abstract
p53 este un supresor al tumorii critice
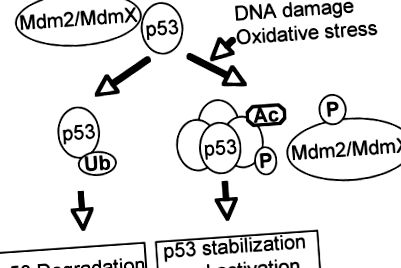
Supresorul tumoral critic p 53 joacă roluri importante în oprirea ciclului celular, apoptoză, senescență sau diferențiere ca răspuns la diferite stresuri genotoxice și celulare, inclusiv stresul oxidativ (73, 102, 133). Ca gardian al genomului, inactivarea funcției p53 de tip sălbatic prin mutația genetică directă sau întreruperea căilor importante pentru activarea p53 este o condiție prealabilă pentru dezvoltarea majorității cancerelor umane (35, 92, 127). Ca factor de transcripție, p53 constă din două domenii de transactivare N-terminale, un domeniu central de legare a ADN-ului și un domeniu de oligomerizare C-terminal (55, 92). Datorită activității sale puternice în inducerea apoptozei și senescenței, stabilitatea și activitatea p53 sunt strâns reglementate de mecanisme posttranslaționale (47, 51, 129). În absența stresurilor, p53 este inactiv și instabil din cauza interacțiunii sale cu Mdm2 și MdmX, care inactivează p53 și ubiquitinate p53 pentru degradarea dependentă de proteazom (Fig. 1). Ca răspuns la stresuri, p53 este modificat posttranslațional prin fosforilare, acetilare, metilare și sumoilare în diferite situri, perturbând interacțiunea dintre p53 și regulatorii săi negativi, ducând la activarea și stabilizarea p53 (68, 85, 104).
Activarea p53 ca răspuns la deteriorarea ADN-ului și la stresul oxidativ. În absența stresurilor, regulatorii negativi ai p53, cum ar fi Mdm2/MdmX, suprimă activitatea p53 și induc degradarea acesteia. Ca răspuns la deteriorarea ADN-ului și la stresul oxidativ, p53 și regulatorii săi negativi sunt modificați posttranslațional, ducând la activarea p53 prin perturbarea interacțiunii dintre p53 și regulatorii săi negativi.
Ca factor de transcripție, p53 poate regla direct expresia a sute de gene, ale căror produse mediază diferite funcții dependente de p53 (Fig. 2) (43, 53, 69). De exemplu, p21 și 14-3-3σ sunt responsabile de oprirea ciclului celular dependent de p53 (30, 31, 50); p53 poate induce, de asemenea, diferențierea celulelor stem embrionare (ES) prin suprimarea expresiei Nanog, care este necesară pentru auto-reînnoirea celulelor ES (64). Ca răspuns la un nivel ridicat de deteriorare a ADN-ului, p53 induce apoptoza și senescența prin reglarea în sus a genelor apoptotice precum Noxa și Puma (66, 71). Aceste funcții ale p53 previn trecerea daunelor ADN către celulele fiice și astfel mențin stabilitatea genomică. Ca răspuns la stresul oxidativ, p53 activează transcrierea mai multor gene implicate în reglarea stresului oxidativ, cum ar fi Sestrina, glutation peroxidaza (GPX), aldehida dehidrogenaza (ALDH) și proteina tumorală 53 - indusă de proteina nucleară 1 (TP53INP1). 14, 16, 115, 130). P53 poate regla, de asemenea, nivelurile de stres oxidativ celular prin modularea glicolizei prin inducerea expresiei TIGAR (glicoliză indusă de TP53 și regulator al apoptozei) și suprimarea expresiei fosfogliceratului mutazic (PGM) (9, 58).
Genele țintă p53 sunt mediatori ai diferitelor funcții dependente de p53 ca răspuns la deteriorarea ADN-ului și la stresul oxidativ.
p53 și îmbătrânire
Studii recente au legat funcțional p53 de îmbătrânirea în diferite organisme (Fig. 3). Ortologul p53 din Caenorhabditis elegans, Cep-1, este implicat în reglarea negativă a duratei de viață a viermelui, deoarece expresia redusă a Cep-1 are ca rezultat o longevitate crescută (4). Exprimarea versiunilor dominant-negative ale Drosophila melanogaster p53 (Dmp53) în neuronii adulți extinde durata de viață și crește rezistența la stres genotoxic în zbor (8). Deoarece expresia Dmp53 dominant-negativ nu crește în continuare durata de viață a muștelor cu restricții calorice, aceste constatări sugerează că p53 este implicat în medierea duratei de viață restricționată la calorii la muște. Cu toate acestea, studiile de mutageneză în C. elegans arată că anumite mutații care extind durata de viață cresc activitățile p53 și rezistența la cancer (94). Prin urmare, activitățile crescute de p53 sunt asociate atât cu îmbătrânirea accelerată, cât și cu durata crescută de viață la C. elegans.
Rezumatul modulației efectelor p53 asupra duratei de viață a diferitelor organisme.
Un scenariu la fel de complicat este observat și la studierea rolurilor p53 în îmbătrânirea mamiferelor. Un model de șoarece, în care capătul N-terminal al p53 este trunchiat, prezintă activități p53 crescute și îmbătrânire accelerată (119). Cu toate acestea, din cauza ștergerii mari a ADN-ului genomic în amonte de p53 care conține 24 de gene (40), rămâne neclar dacă oricare dintre aceste gene șterse este responsabilă pentru aceste fenotipuri de îmbătrânire. Implicarea potențială a N-terminal - p53 trunchiat în timpul îmbătrânirii este susținută în continuare de supraexprimarea izoformei p53 eliminate N-terminal - p53 la șoareci, ducând la îmbătrânirea accelerată (72). Acest studiu sugerează că p44 modulează durata de viață prin inhibarea căilor de semnal PTEN și IGF (39, 75, 110). Pentru a lega p53 de îmbătrânire la om, un studiu recent arată că polimorfismul p53 la codonul 72 (substituție arginină-prolină) reduce activitățile p53, corelându-se cu durata de viață crescută, dar și cu un risc mai mare de cancer la persoanele în vârstă (120). Prin urmare, s-a sugerat că p53 ar putea suprima cancerul în detrimentul longevității.
Noțiunea că creșterea activității p53 induce îmbătrânirea la șoareci este contestată de studii recente asupra modelelor de șoareci cu activități crescute de p53. De exemplu, șoarecii cu mutație hipomorfă în Mdm2 prezintă o activitate p53 crescută, dar durata de viață normală (78). În plus, șoarecii cu o copie suplimentară de p53 și ARF au prezentat o expresie îmbunătățită a activității antioxidante și niveluri scăzute de stresuri oxidative endogene, corelate cu durata de viață crescută (74). Prin urmare, activitatea antioxidantă crescută a p53 la acești șoareci transgenici previne acumularea de stresuri oxidative la nivelurile ridicate necesare pentru a induce apoptoza și senescența dependente de p53, întârziind astfel îmbătrânirea acestor șoareci. Pe scurt, funcțiile p53 în timpul îmbătrânirii sunt complexe și ar putea fi dependente de context. În acest context, activarea ușoară și tranzitorie a p53 ca răspuns la o doză mică de stres oxidativ ar putea proteja celulele de deteriorarea oxidativă. În schimb, activarea persistentă a p53 ca răspuns la niveluri ridicate de stres oxidativ poate duce la moartea celulară și îmbătrânirea organismului. În sprijinul suplimentar al acestei noțiuni, activarea persistentă a p53 epuizează celulele stem adulte în principal prin apoptoză dependentă de p53 (64).
Stresul oxidativ și îmbătrânirea
Ipoteza radicalilor liberi rămâne cea mai bine stabilită teorie asupra mecanismului îmbătrânirii (46). Se crede că producția crescută de ROS și o capacitate antioxidantă scăzută contribuie la procesul de îmbătrânire prin modificarea oxidativă a diferitelor macromolecule, cum ar fi lipidele, proteinele și ADN-ul genomic (12, 20, 25, 62, 63, 65, 96, 109, 117). În contextul ADN-ului, deteriorarea oxidativă a ADN-ului mitocondrial și nuclear este semnificativ crescută în diferite țesuturi la șobolani și șoareci vechi (20, 45, 61, 67, 76, 82, 116). Nivelurile produselor de peroxidare a lipidelor sunt, de asemenea, crescute odată cu îmbătrânirea (44, 83, 87, 97, 108, 113, 119, 123). În plus, modificarea oxidativă legată de îmbătrânire a diferitelor proteine determină modificări în structura proteinelor, activitățile enzimatice, activitățile transcripționale și căile de transducție a semnalului (32, 70, 103, 111, 112, 124), ducând la boli legate de vârstă. Pe scurt, nivelurile de deteriorare oxidativă sunt crescute în timpul îmbătrânirii în diferite organisme, inclusiv C. elegans (11, 52, 121), muște (3, 64) și șoareci (22, 74, 79).
În susținerea în continuare a noțiunii că stresul oxidativ este un inductor al îmbătrânirii, tratamentul cu antioxidanți poate crește durata de viață a diferitelor organisme și are un impact benefic asupra bolilor legate de îmbătrânire (6, 29, 38, 57, 114, 119). O doză mică de supliment alimentar cu antioxidanți imită parțial efectele restricției calorice și întârzie îmbătrânirea la șoareci (6) și tratamentul pe termen lung cu eliminarea radicalilor liberi Schisandrin B, un derivat dibenzociclooctadienic izolat din fructul Schisandra chinensis, întârzie îmbătrânirea afectarea funcțională legată de diferite organe și îmbunătățește rata de supraviețuire a șoarecilor în vârstă (114). Un supliment alimentar de cisteină, care este necesar pentru sinteza glutationului antioxidant primar, are beneficii clare în întârzierea unor aspecte ale îmbătrânirii (29). Cu toate acestea, studiile clinice nu au găsit nici efecte benefice semnificative ale suplimentării cu vitamina E antioxidantă, indicând faptul că nu toți antioxidanții au activități anti-îmbătrânire (55, 107, 125).
p53 și stresul oxidativ
Nivelurile ROS au un impact semnificativ asupra creșterii, supraviețuirii și dezvoltării celulelor și tumorigenezei (17). p53 joacă roluri cheie și complexe în răspunsurile celulare la stresul oxidativ (84, 100). Ca răspuns la niveluri scăzute de stres oxidativ, p53 joacă în primul rând roluri antioxidante. În acest context, un număr de gene țintă p53, inclusiv Sestrin, glutation peroxidază (GPX) și aldehidă dehidrogenază (ALDH), sunt implicate în reducerea stresului oxidativ (Fig. 4). De exemplu, Sestrin protejează celulele de daune induse de peroxidul de hidrogen prin generarea de peroxiredoxine (14). GPX este o enzimă antioxidantă primară care elimină peroxidul de hidrogen sau hidroperoxizii organici (115). Aldehida dehidrogenaza (ALDH) contribuie, de asemenea, la funcția antioxidantă a p53 (130).
Rolurile p53 dependente de context în răspunsurile celulare la stresul oxidativ prin activarea genelor țintă distincte. La niveluri bazale sau scăzute de stres oxidativ, p53 reglează expresia Sestrin, GPX, ALDH, TP53INP1, SOD2, TIGAR și PGM pentru a elimina ROS și, prin urmare, promovează supraviețuirea celulară. Ca răspuns la niveluri ridicate de stres oxidativ, p53 induce expresia genelor prooxidative și suprimă expresia genelor antioxidante pentru a crește nivelul ROS și pentru a promova apoptoza. Antioxidanții dezechilibrați pot induce, de asemenea, ROS pentru a promova moartea celulelor.
P53 poate reduce, de asemenea, nivelurile intracelulare ale ROS prin reglarea metabolismului celular. În acest context, p53 induce expresia TIGAR (glicoliză indusă de TP53 și regulator al apoptozei), care încetinește glicoliza și promovează producția de NAPDH pentru a scădea nivelurile ROS (9). În plus, p53 suprimă expresia fosfogliceratului mutazic (PGM), ducând la o scădere a piruvatului necesar pentru respirația oxidativă în mitocondrii și, astfel, producția redusă de ROS (10, 74).
Ca răspuns la niveluri ridicate de stres oxidativ, p53 prezintă activități prooxidative prin activarea genelor prooxidative, cum ar fi PIG3 și prolina oxidază (27, 95). Supraexprimarea acestor gene duce la niveluri mai ridicate de stres oxidativ. În plus, p53 induce expresia BAX și PUMA, care induce apoptoza prin eliberarea citocromului c din mitocondrii (66, 71). Activitățile prooxidative ale p53 includ, de asemenea, inhibarea expresiei genelor antioxidante, ceea ce duce la creșterea stresului oxidativ celular pentru a induce apoptoza. De exemplu, p53 ar putea reprima expresia SOD2 și Nrf2, rezultând sensibilitate la stres oxidativ sau inducând apoptoză (28, 34, 91). Interesant este faptul că reglarea în sus a MnSOD și GPX indusă de p53, dar nu catalaza, crește stresul oxidativ și apoptoza (54), sugerând că echilibrul enzimei antioxidante și stresului oxidativ este important pentru supraviețuirea celulelor. Pe scurt, p53 joacă roluri importante, dar dependente de context, în reglarea stresului oxidativ celular, iar nivelurile de deteriorare a stresului oxidativ dictează dacă comportamentul p53 este cel al unui protector sau al unui criminal (100).
p53 interacționează cu alte căi implicate în stresul oxidativ și îmbătrânirea
În plus față de reglarea directă a genelor implicate în stresul oxidativ, p53 interacționează și cu alte căi care sunt implicate în stresul îmbătrânirii și oxidative, care sunt rezumate aici (Fig. 5).
Interacțiunea funcțională între p53 și alte căi importante pentru răspunsul la stres oxidativ și îmbătrânire.
Sirt1
p66Shc
p66Shc, o țintă din aval de p53, este indispensabilă pentru creșterea dependentă de p53 a stresului oxidativ intracelular și a apoptozei (118). p66Shc este o variantă de îmbinare a p52Shc/p46Shc, un traductor de semnal citoplasmatic implicat în transmiterea semnalului mitogen de la receptorii activați la Ras (93). Cu toate acestea, p66Shc nu este implicat în reglarea semnalului Ras, ci este implicat în inducerea apoptozei ca răspuns la stresul oxidativ (80). Rolul important al p66Shc în stresul oxidativ și în îmbătrânire este indicat de constatările că ablația p66Shc îmbunătățește rezistența celulară la apoptoză indusă de stresul oxidativ și prelungește durata de viață a șoarecilor cu deficiență de p66Shc (79). În acest context, eliberarea citocromului c după semnale oxidative este afectată în celulele cu deficit de p66Shc (90). Prin urmare, p66Shc leagă funcțional p53 de răspunsul la stres oxidativ și îmbătrânire.
Factorii de transcripție a cutiei O (FoxO) sunt mediatori importanți ai căii de semnalizare PI3K/Akt și reglează răspunsurile celulare la stresul oxidativ și durata de viață (56, 105). p53 reglează negativ activitățile FoxO prin inducerea expresiei kinazei induse de ser și glucocorticoizi (SGK), un regulator negativ al FoxO și PTEN (37). În plus, Sirt1 poate deacetila FoxO3 și FoxO4, atenuând astfel apoptoza indusă de FoxO și oprirea ciclului celular (41). Prin urmare, echilibrul interacțiunii funcționale dintre Sirt1, FoxO și p53 ar putea juca roluri importante în reglarea stresului oxidativ și a îmbătrânirii.
APE/Ref1
Expresia APE/Ref1 este redusă în celulele stem mezenchimale derivate din măduva osoasă umană senescentă (hBMSC) cu niveluri crescute de ROS endogen. Supraexprimarea APE1/Ref-1 suprimă producția de superoxid și scade senescența în hBMSC (48). În plus, șoarecii în vârstă au o inducție afectată a APE ca răspuns la deteriorarea oxidativă (15). Activitățile APE/Ref1 sunt reglementate negativ de p53 (131), implicând o altă cale pentru p53 pentru a modula stresul oxidativ și îmbătrânirea.
Caveolin-1
Exprimarea Caveolin-1 este indusă la fibroblastele supuse senescenței induse de stres oxidativ, iar antioxidantul previne senescența și reglarea ascendentă a Caveolin-1 (36, 126). Supraexprimarea Caveolin-1 în MEF induce senescența prematură printr-o cale dependentă de p53-p21, sugerând că Caveolin-1 ar putea activa senescența prematură dependentă de p53 după stres oxidativ (36). În acest context, Caveolin-1 se leagă de Mdm2 și perturbă legarea Mdm2 de p53, ducând la activarea p53 ca răspuns la stresul oxidativ. Activarea p53 și inducerea senescenței premature sunt compromise în Caveolin-1 - MEF nule, confirmând că Caveolin-1 este un activator în amonte al p53 ca răspuns la stresul oxidativ (7).
Calea FoxM1C-Bmi1
Bmi1 este un regulator negativ al Ink4a/Arf și p53; FoxM1C induce expresia Bmi1 pentru a preveni senescența celulară indusă de stresul oxidativ prin inhibarea expresiei p53 (13, 18, 33, 89). Bmi1 este important pentru a reprima activitățile prooxidante ale p53 în neuroni și pentru a suprima apoptoza indusă de stresul oxidativ și fenotipurile asemănătoare îmbătrânirii premature (18). În plus, epuizarea țintită a Bmi1 sensibilizează celulele tumorale la apoptoza mediată de p53 ca răspuns la radioterapie (2).
Bach1
Pentru factorii de transcripție, recrutarea co-activatorilor sau co-represorilor către promotorii țintă p53 este critică pentru transcrierea dependentă de p53. Bach1 este indus de stresuri oxidative și formează un complex cu p53, histon deacetilaza 1 și co-represor nuclear N-coR, promovând deacetilarea histonelor și suprimarea anumitor gene țintă p53 (26). În acest context, Bach1 inhibă senescența celulară indusă de stresul oxidativ prin perturbarea expresiei genei dependente de p53 (26).
Concluzie
Acumularea de stres oxidativ și daune oxidative este un inductor major al îmbătrânirii. Multe căi implicate în răspunsurile celulare la stresul oxidativ reglează procesul de îmbătrânire și durata de viață a diferitelor organisme. P53 joacă roluri importante, dar dependente de context, în răspunsurile celulare la niveluri scăzute sau ridicate de stres oxidativ. Ca răspuns la niveluri scăzute de stres oxidativ, p53 prezintă activități antioxidante și promovează supraviețuirea celulară; ca răspuns la niveluri ridicate de stres oxidativ, p53 prezintă activități prooxidative pentru inducerea apoptozei celulare. Ambele funcții ale p53 pot preveni acumularea de leziuni oxidative în celule și astfel pot menține stabilitatea genomică. p53 îndeplinește aceste funcții prin reglarea directă transcripțională a genelor implicate în răspunsurile la stres oxidativ sau modulând alte căi importante în răspunsurile la stres oxidativ.
- Suplimentarea PRIME PubMed Coenzima Q10 scade stresul oxidativ hepatic și inflamația
- Leziunea renală indusă de obezitate este asociată cu stresul oxidativ prin reperfuzie de ischemie renală
- Rolul proteinei dietetice și al fitnessului muscular asupra longevității și îmbătrânirii
- Obezitatea la adulți Portalul McMaster Optimal Aging
- Obezitatea este o formă de îmbătrânire prematură, spun oamenii de știință, și trebuie să o regândim