Keith Elkon
Profesor de medicină și șef al diviziei de reumatologie la Școala de Medicină a Universității din Washington, Seattle, WA, SUA
Paolo Casali
Donald L Bren Profesor de medicină, biologie moleculară și biochimie și director al Centrului de Imunologie de la Universitatea din California, Irvine, CA, SUA
REZUMAT
INTRODUCERE
Autoanticorpii sunt anticorpi care reacționează cu autoantigenele. Acești antigeni pot fi găsiți în toate tipurile de celule (de exemplu, cromatină, centromeri) sau pot fi foarte specifice pentru un anumit tip de celule dintr-un organ al corpului (de exemplu, tiroglobulină în celulele glandei tiroide). Ele pot cuprinde proteine, acizi nucleici, carbohidrați, lipide sau diverse combinații ale acestora. În lupusul sistemic și tulburările autoimune sistemice conexe, antigenele dominante sunt ribonucleoproteinele (RNP) sau dezoxiribonucleoproteinele, din motive care vor fi descrise mai târziu în acest articol. Mulți autoanticorpi sunt biomarkeri utili ai bolii. De asemenea, ne pot informa despre mecanismele de bază ale pierderii toleranței și inflamației la pacienții cu tulburări autoimune.
În ciuda eliminării fiziologice (selecție negativă) sau a inactivării funcționale (anergie) a limfocitelor T și B auto-reactive din timus și, respectiv, din măduva osoasă, există dovezi convingătoare că celulele persistente cu afinitate scăzută, potențial autoreactive și că este necesară o reactivitate cu afinitate scăzută la autoantigene pentru supraviețuirea limfocitelor T și probabil a B în sistemul imunitar periferic. În mod surprinzător, prin urmare, IgM și, ocazional, autoanticorpi IgG cu titru scăzut, de exemplu factori reumatoizi (RF), anticorpi împotriva ADN monocatenar (ss) și anticorpi antinucleari, sunt detectați la persoanele sănătoase. Așa cum se va discuta mai târziu în această revizuire, proprietățile acestor autoanticorpi cu afinitate scăzută, în principal IgM nemutată diferă fundamental de cele ale auto-anticorpilor IgG cu afinitate ridicată, mutate somatic în stările de boală, denumiți în această revizuire ca autoanticorpi patogeni. Aici vom discuta despre modul în care apar acești anticorpi patogeni, ce contează specificitatea lor, cum provoacă boli și dacă au valoare ca biomarkeri ai bolilor specifice.
STIMULURI PENTRU GENERAREA AUTOANTICORPILOR
Prezența autoanticorpilor foarte specifici pentru organele țintă în bolile autoimune specifice organelor, cum ar fi tiroidita, diabetul zaharat de tip 1 și ciroza biliară primară, sugerează cu tărie că autoanticorpii sunt stimulați de inflamația organului țintă, deși reactivitatea încrucișată cu antigenii microbieni ( mimica moleculară) nu poate fi exclusă. Autoantigenele post-translaționale modificate par a provoca autoanticorpi care sunt foarte specifici și au valoare prognostică. În bolile autoimune sistemice, cum ar fi lupusul sistemic, originea autoanticorpilor este mai puțin clară deoarece anticorpii sunt nespecifici de tip celular și afectează mai multe organe țintă. După cum s-a discutat mai târziu, modelele genetice indică faptul că autoanticorpii către antigeni intracelulari pot fi stimulați de antrenarea antigenică excesivă a antigenelor eliberate din celulele pe moarte, precum și de răspunsurile îmbunătățite asociate cu anomalii intrinseci în limfocitele B sau T.
GENERAREA AUTOANTICORPILOR PATOGENICE
Autoanticorpi naturali
Anticorpii care se leagă de o varietate de antigeni exogeni, cum ar fi cei de pe bacterii, viruși și ciuperci, precum și auto-antigene (de exemplu, acizi nucleici, fosfolipide, eritrocite, proteine serice, componente celulare, insulină sau tiroglobulină) reprezintă un proporție semnificativă de imunoglobuline la persoanele sănătoase. 1 Deoarece apar independent de imunizarea cunoscută și/sau deliberată, au fost denumiți anticorpi naturali sau autoanticorpi. Datorită reactivității lor largi pentru o mare varietate de componente microbiene, anticorpii naturali au un rol major în linia principală de apărare împotriva infecțiilor. 2 - 5 Deoarece recunosc, de asemenea, o varietate de auto-antigeni, au un rol în dezvoltarea repertoriului de celule B și în homeostazia sistemului imunitar. 6
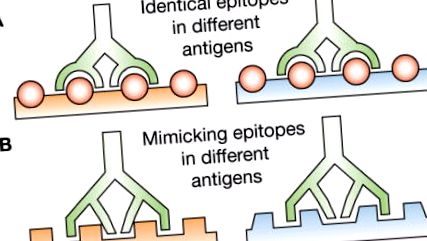
Majoritatea autoanticorpilor naturali sunt IgM și polreactivi, adică se leagă de mai mulți antigeni fără legătură, în general cu afinitate intrinsecă moderată, deși există și anticorpi naturali mono-reactivi. 1, 7, 8 În ciuda afinității intrinseci scăzute până la moderate a siturilor lor de legare a antigenului, datorită decavalenței lor anticorpii IgM naturali posedă o aviditate generală mare de legare, o caracteristică care face ca acești anticorpi să fie deosebit de eficienți în legarea antigenilor cu un structură repetitivă pe suprafața celulelor, țesuturilor, bacteriilor și virusurilor (Caseta 1). Autoanticorpii naturali sunt produși în principal de celulele B-1 (CD5 +), 9 de limfocitele predominante în repertoriul de celule B neonatale și de celulele B din zona marginală. 10 - 12 celule B-1 sunt extrem de eficiente în prezentarea antigenului 13 și pot juca un rol important în producerea de auto-anticorpi patogeni în mai multe boli autoimune, inclusiv artrita reumatoidă, sindromul Sjögren, sindromul antifosfolipidic primar și lupusul sistemic. 14 - 18
Caseta 1 Poliactivitatea anticorpilor
Selecția somatică conduce la autoanticorpi cu afinitate ridicată și cu comutare de clasă
Deși autoanticorpii naturali pot, în condiții adecvate, să ofere șabloane pentru apariția autoanticorpilor patogeni cu afinitate superioară și comutați de clasă, rolul lor fiziologic și patogen precis rămâne de definit.
Anomalii genetice predispozante la producerea de autoanticorpi
Producerea de autoanticorpi patogeni implică o încălcare substanțială a toleranței la auto-antigeni. Studiile genetice la om au indicat că boala clinică autoimună completă rezultă din modificări genetice multiple care sunt susceptibile de a fi influențate de factori de mediu. În ciuda naturii poligenice a tulburărilor autoimune umane, eliminarea și supraexprimarea genelor unice la modelele de șoareci au fost deosebit de instructive în elucidarea mai multor căi cheie care conduc la autoimunitate asociată cu producția de autoanticorpi. Vom evidenția pe scurt aici modificări genetice spontane sau induse în trei căi generale care duc la lupus sistemic sau boli asemănătoare poliartritei reumatoide la șoareci.
Supraviețuirea anormală a limfocitelor autoreactive
Modificările moleculelor care favorizează supraviețuirea anormală a limfocitelor autoreactive sunt bine descrise. Exemple de astfel de modificări sunt mutațiile din Fas/CD95 care duc la fenotipul lpr la șoareci și sindromul limfoproliferativ autoimun/sindromul Canale Smith la om, 39 supraexprimarea stimulatorului de celule B BLyS (cunoscut și sub numele de BAFF) și supraexprimarea regulatorului antiapoptotic. Bcl-2.
Eliminarea defectuoasă a celulelor apoptotice
S-a raportat că pierderea sau deficiențele funcției unui număr de proteine implicate în îndepărtarea celulelor apoptotice cauzează boli de tip lupus la șoareci. Proteinele implicate includ receptori, cum ar fi Mer, precum și opsoninele serice (de exemplu, anticorpii IgM naturali, C1q, componenta serică amiloid P [SAP] și factorul de creștere epitelial al globulinei din grăsime din lapte-8 [MFG-E8]), care acoperă moartea celule. 40, 41 Mecanismele implicate diferă. Deficitul de Mer are ca rezultat ca macrofagele să primească mai degrabă un semnal proinflamator decât antiinflamator la ingestia de celule apoptotice. Clearance-ul defectuos al celulelor apoptotice la șoarecii knockout IgM, C1q, SAP și MFG-E8 de suprafață ar putea predispune la lupus prin clearance-ul lent al celulelor apoptotice ducând la necroză postapoptotică și/sau prin lipsa angajării cu receptori inhibitori specifici pe fagocit. Locurile în care se manifestă apoptoza defectă diferă; la șoarecii cu deficit de C1q, celulele apoptotice se acumulează în rinichi, în timp ce la șoarecii knockout MFG-E8, celulele apoptotice se acumulează în centrele germinale.
Defalcarea reglării pragului de activare a celulelor B sau a celulelor T
Au fost raportate modificări genetice la șoareci deficienți în molecule care reglează pragul activării celulelor B sau celulelor T, cum ar fi cbl-b, PD-1 și Zap-70 și grupul SLAM din celulele T, și Lyn și FcγRIIb în Celulele B. Aceste modificări genetice duc la autoreactivitatea limfocitelor din sistemul imunitar periferic. În general, atunci când limfocitele sunt mai ușor activate, acestea sunt mai susceptibile de a promova producerea de auto-anticorpi similari cu autoanticorpii găsiți în lupusul sistemic uman. Predominanța autoanticorpilor de tip lupus se explică probabil prin expunerea celulelor imune la celulele moarte ca parte a rotației normale a celulelor în splină și ganglioni limfatici. Mutațiile din Zap-70, totuși, duc la o boală foarte asemănătoare cu artrita reumatoidă umană, inclusiv producerea de RF, 42 în timp ce expresia autoimunității la șoarecii cu deficit de PD-1 diferă, în funcție de fondul genetic al gazdei: lupus în C57BL/6 și miocardită la șoareci BALB/c.
SPECIFICITATEA AUTOANTICORPULUI
Celulele pe moarte și resturile celulare servesc drept antigeni
Receptorii de tip interferon-α și Toll
Autoanticorpii patogeni provoacă inflamații și leziuni tisulare. (A) Autoanticorpii produși de limfocitele B se leagă de autoantigenele eliberate de celulele apoptotice sau necrotice, formând complexe antigen - anticorp (imun). Când antigenele din complexele imune conțin acizi nucleici și sunt endocitate de pDC, receptorii de tip Toll sunt activați și pDC secretă interferon-α. Această citokină activează limfocitele B și T, precum și APC, cum ar fi macrofagele și celulele dendritice. În plus, complexele imune ar putea fi fagocitate de APC, rezultând eliberarea altor citokine inflamatorii (factor de necroză tumorală-α, interleukină-6) și chemokine. (B) Complexele imune se depun în vase, precum și în rinichi și plămâni. Complexele imune activează căile inflamatorii prin interacțiunea cu FcyR și complement. Abrevieri: APC, celulă care prezintă antigen; pDC, celulă dendritică plasmacitoidă.
CUM CAUZĂ AUTOANTICORPII BOLI?
Teoretic, autoanticorpii pot fi neutri sau pot avea efecte benefice sau dăunătoare. De exemplu, în timp ce autoanticorpii împotriva tiroglobulinei ar putea să nu aducă o contribuție critică la tiroidită, stimulatorii tiroidieni cu acțiune îndelungată (adică autoanticorpii către receptorul TSH) sunt responsabili pentru tirotoxicoză. Autoanticorpii naturali ar putea fi utili în îndepărtarea resturilor celulare în timpul inflamației, iar autoanticorpii la citokinele inflamatorii ar putea proteja împotriva inflamației nepotrivite. 48 În tulburările autoimune sistemice, mulți autoanticorpi par a fi direct dăunători după depunerea în țesut; s-ar putea, de asemenea, să amplifice inflamația și să perpetueze producția de autoanticorpi transportând auto-nucleoproteinele în celulă și angajând receptori de tip Toll, așa cum sa discutat anterior (Figura 1).
Unii autoanticorpi angajează căi efectoare complementare și/sau FcγR care duc la inflamație. Complexele antigen-anticorp sunt bine cunoscute pentru a provoca vasculită și glomerulonefrită. 49 Activarea complementului a fost demonstrată în mod constant în modele experimentale de boală imun-complexă și în rinichii pacienților cu lupus sistemic și nefrită lupică. 50 Alte exemple de autoanticorp - leziune mediată de complement includ modelul de transfer pasiv al pierderii fetale asociate cu sindromul antifosfolipidic 51 și o formă neobișnuită de activare a căii alternative complementare, indusă de administrarea autoanticorpului la șoarecele transgenic K/BxN ca model a poliartritei reumatoide. 52 În mod curios, în acest din urmă model, calea alternativă a complementului este activată de auto-anticorpi patogeni direcționați împotriva antigenului glucoză-6-fosfat izomerază. Activarea complementului determină predominant inflamația prin eliberarea anafilotoxinei C5a, rezultând atracția neutrofilelor și eliberarea enzimelor proteolitice și a citokinelor inflamatorii.
În modelul murin NZB/W F1 de nefrită lupică mediată de complex imunitar, șoarecii lipsiți de lanțul FcyRY au fost protejați de nefrită, indicând un rol critic pentru FcyRs în inflamația țesuturilor. 53 Prin contrast, șoarecii cu FcγRIIb bătăiți spontan dezvoltă o boală asemănătoare lupusului. 54 Anticorpii de izotipuri diferite au afinități variate pentru cei patru FcγRs. IgG2a are o afinitate mai mare pentru FcyRIV, ducând la răspunsuri inflamatorii, în timp ce IgG1 angajează selectiv FcyRIIb, inhibând răspunsurile inflamatorii. 55 Este probabil că relații similare vor fi găsite cu FcyR umane și capacitatea de a proteja sau de a induce inflamația va depinde, parțial, de isotipul autoanticorpului și FcγR angajat.
AUTOANTICORPI ÎN DIAGNOSTIC
Titrurile unor autoanticorpi, cum ar fi RF și cele ale ADNs, sunt crescute în infecții și o varietate de tulburări autoimune și, prin urmare, sunt de puțin ajutor în diagnosticul diferențial al bolii. În schimb, majoritatea autoanticorpilor găsiți în bolile autoimune sistemice nu sunt detectați în infecțiile cronice. Un rezultat negativ pentru anticorpul antinuclear, atunci când este testat prin imunofluorescență indirectă pe celulele HEp-2, face ca diagnosticul lupusului sistemic sau al altei boli autoimune sistemice să fie puțin probabil, în timp ce un test pozitiv cu un titru mai mare de 1/160 susține cu tărie diagnosticul. La fel, spre deosebire de sensibilitatea ridicată și specificitatea scăzută a RF pentru artrita reumatoidă, autoanticorpul anti-CCP are, în general, o sensibilitate de 40-70%, dar specificitatea ar putea fi de până la 98%. Aproximativ 90% dintre pacienții cu artrită nediferențiată și titruri crescute de auto-anticorpi anti-CCP vor dezvolta artrită reumatoidă în termen de 3 ani. 44
Puțini autoanticorpi pot fi folosiți singuri pentru a diagnostica o boală autoimună, deoarece persoanele fără boală clinică evidentă, în special rudele pacienților cu boli autoimune, pot avea titruri detectabile. Mai mult, unii autoanticorpi, deși foarte specifici, sunt prezenți doar la o minoritate de pacienți. De exemplu, autoanticorpii către Sm apar doar la 3-30% dintre pacienții cu lupus sistemic. Din aceste motive, detectarea autoanticorpilor este de obicei utilizată pentru a confirma un diagnostic clinic sau pentru a ajuta la definirea unui subgrup de pacienți dintr-o categorie de diagnostic.
CONCLUZII
Autoanticorpii cu calități diferite există și este probabil ca autoanticorpii IgM naturali polreactivi cu afinitate scăzută, dar cu aviditate ridicată, să aibă roluri de menaj. În general, autoanticorpii IgG cu afinitate ridicată care au suferit hipermutație somatică și comutare de clasă reflectă un proces patologic. Departe de a fi epifenomene în boli autoimune sistemice, acești anticorpi cauzează frecvent leziuni tisulare. Acest lucru se întâmplă nu numai prin activarea directă a IgG Fc a căilor efectoare, ci și prin absorbția și ingestia de complexe imune de către celule, ceea ce duce la activarea senzorilor receptorilor de tip Toll ai acizilor nucleici și la eliberarea citokinelor inflamatorii. Specificitatea multor auto-anticorpi are o mare utilitate de diagnostic și ar putea avea, de asemenea, o valoare predictivă, cum ar fi cu autoanticorpii anti-CCP în artrita reumatoidă. Specificitatea autoanticorpilor în auto-imunitatea sistemică sugerează, de asemenea, o relație intimă cu patogeneza bolii - o poveste încă de desfășurat.
PUNCTE CHEIE
Anticorpi naturali sau autoanticorpi, în special IgM, care reacționează cu auto-molecule apar la indivizi normali și prezintă o afinitate moderată, dar aviditate mare pentru auto-antigeni
Autoanticorpii IgG cu afinitate ridicată, cu mutație somatică, cu comutare de clasă reflectă un proces patologic în care sunt perturbate căile homeostatice legate de clearance-ul celular, semnalizarea receptorilor antigenului sau funcțiile efectorului celular
Mecanismele implicate în leziunea țesutului mediată de complexul imun includ angajarea FcyR și activarea complementului, precum și internalizarea și activarea receptorilor de tip Toll
Autoanticorpii ar putea fi detectabili cu mult înainte de debutul bolii și să servească drept biomarkeri care să permită diagnosticarea și direcționarea intervenției terapeutice
În bolile autoimune specifice organelor, autoanticorpii rănesc direct organele țintă; în bolile autoimune sistemice, ele se pot lega de asemenea la diferite molecule de sine și pot provoca boli prin formarea de complexe imune
Sunt necesare cercetări pentru a clarifica de ce anumiți antigeni sunt vizați în diferite boli autoimune și modul în care unii anticorpi se activează, în timp ce alții inhibă răspunsurile imune
Note de subsol
CRITERII DE EXAMENARE
Articolele publicate pentru includerea în această revizuire au fost identificate folosind PubMed din înregistrările extinse ale lucrărilor privind bolile autoimune specifice organelor și sistemice. Termenii incluși în căutare au fost „autoanticorp”, „autoanticorp natural”, „hipermutație somatică” și „comutare de clasă”. Toate lucrările identificate erau lucrări cu text integral în limba engleză. Listele de referință ale articolelor identificate au fost, de asemenea, căutate manual pentru alte lucrări.
Interese concurente
Autorii nu au declarat interese concurente.
Informații despre colaboratori
Keith Elkon, profesor de medicină și șef al diviziei de reumatologie la Facultatea de Medicină a Universității din Washington, Seattle, WA, SUA.
Paolo Casali, Donald L Bren Profesor de medicină, biologie moleculară și biochimie și director al Centrului pentru Imunologie de la Universitatea din California, Irvine, CA, SUA.
- Nature Made Cum sunt reglementate suplimentele; Nature Made®
- Nature s Wisdom Wellness Association - Wellness Center din Westerly, RI SUA Mirosul corpului și respirația urâtă
- Produse Nature s Sunshine - Para Cleanse
- Răspunsul naturii Ginseng Eleuthero
- Nature s Sunshine Products NSP Vizualizare subiect - Apel concentrat pe produsul Cleanse Liquid