Olav Olsen
1 Departamentul de fiziologie, Universitatea din California, San Francisco, San Francisco, CA 94143
Kimberly A. Moore
2 Departamentul de farmacologie celulară și moleculară, Universitatea din California, San Francisco, San Francisco, CA 94143
Masaki Fukata
1 Departamentul de fiziologie, Universitatea din California, San Francisco, San Francisco, CA 94143
Toshinari Kazuta
1 Departamentul de fiziologie, Universitatea din California, San Francisco, San Francisco, CA 94143
Jonathan C. Trinidad
3 Departamentul de chimie farmaceutică, Universitatea din California, San Francisco, San Francisco, CA 94143
Fred W. Kauer
1 Departamentul de fiziologie, Universitatea din California, San Francisco, San Francisco, CA 94143
Michel Streuli
4 ImmunoGen, Inc., Cambridge, MA 02139
Hidemi Misawa
5 Departamentul de Neurologie, Metropolitan Institute for Neuroscience, Tokyo 183-8526, Japonia
Alma L. Burlingame
3 Departamentul de chimie farmaceutică, Universitatea din California, San Francisco, San Francisco, CA 94143
Roger A. Nicoll
1 Departamentul de fiziologie, Universitatea din California, San Francisco, San Francisco, CA 94143
2 Departamentul de farmacologie celulară și moleculară, Universitatea din California, San Francisco, San Francisco, CA 94143
David S. Bredt
1 Departamentul de fiziologie, Universitatea din California, San Francisco, San Francisco, CA 94143
Abstract
Sinapsele sunt joncțiuni intercelulare foarte specializate, organizate de molecule adezive și de schele care aliniază eliberarea veziculară presinaptică cu receptorii neurotransmițătorilor postsinaptici. Complexul MALS/Veli - CASK - Mint-1 de proteine PDZ apare pe ambele părți ale sinapsei și are potențialul de a lega moleculele de aderență transsinaptică de citoschelet. În acest studiu, am purificat complexul proteic MALS din creier și am găsit liprina-α ca componentă majoră. Proteinele liprinice organizează zona activă presinaptică și reglează eliberarea neurotransmițătorului. În mod adecvat, șoarecii mutanți care nu au toate cele trei izoforme MALS au murit perinatal cu dificultăți de respirație și cu transmisie sinaptică excitativă afectată. Curenții postsinaptici de excitare au fost reduși dramatic în culturile autaptice de la șoareci MALS triple knockout din cauza unui deficit presinaptic în ciclul veziculelor. Aceste descoperiri sunt în concordanță cu un model prin care complexul MALS - CASK - liprin-α recrutează componente ale mașinilor de eliberare sinaptică pentru a adera proteinele din zona activă.
Introducere
Transmisia sinaptică necesită alinierea precisă a specializărilor pre- și postsinaptice. Pe partea presinaptică, veziculele sinaptice care conțin neurotransmițători trebuie aliniate și ancorate în zonele active, unde veziculele se fuzionează cu membrana presinaptică pentru secreție (Südhof, 2004). Pe partea postsinaptică, receptorii neurotransmițătorilor trebuie să fie grupați împreună cu mașinile relevante de transducție a semnalului pentru a răspunde emițătorilor eliberați. Studii recente au început să elucideze mecanismul molecular responsabil pentru organizarea joncțiunilor sinaptice. Molecule de adeziune care acoperă funcția de despicătură sinaptică atât în stabilizarea, cât și în definirea zonei active presinaptice și specializarea postsinaptică (Ichtchenko și colab., 1995; Fannon și Colman, 1996; Flanagan și Vanderhaeghen, 1998). Moleculele citosolice asociate cu acești factori adezivi ajută la poziționarea veziculelor sinaptice și a receptorilor neurotransmițătorilor pe laturile lor respective ale sinapselor (Hata și colab., 1996; Torres și colab., 1998; Perego și colab., 2000).
Un astfel de set de proteine modulare de schelă cuprinde un complex ternar de MALS/Veli (omolog LIN-7 de mamifere/omolog vertebrat al LIN-7), CASK (proteină de membrană plasmatică periferică) și Mint-1 (proteină interacțiune 1 munc-18), care sunt omologi de vertebrate ale unui complex identificat pentru prima dată în Caenorhabditis elegans care mediază dezvoltarea vulvalului (Kaech și colab., 1998). În creierul mamiferelor, complexul MALS - CASK - Mint-1 apare pe ambele părți ale joncțiunilor sinaptice și se crede că servește roluri distincte în aceste două locații. Presinaptic, acest complex se leagă de neurexină (Hata și colab., 1996), o moleculă de adeziune care se leagă pe sinapsă de neuroligina postsinaptică (Ichtchenko și colab., 1995). Mai mult, Mint-1 se asociază cu Munc18-1, o componentă esențială a mașinilor de fuziune a veziculelor sinaptice (Okamoto și Südhof, 1997). Postsinaptic, MALS se leagă de N-metil-d-aspartat (NMDA) - tipul receptorilor de glutamat (Jo și colab., 1999) și este raportat că transportă veziculele receptorului NMDA de-a lungul microtubulilor (Setou și colab., 2000).
Studiile genetice nu au reușit să stabilească rolurile esențiale ale complexului MALS - CASK - Mint-1 din creier. Trei gene MALS există la mamifere (Borg și colab., 1998; Butz și colab., 1998; Jo și colab., 1999), iar întreruperea țintită a MALS-1 și MALS-2 duce la o reglare compensatorie a MALS-3 în SNC (Misawa și colab., 2001). Șoarecii mutanți Mint-1 nu prezintă defecte în transmisia sinaptică excitativă și doar un defect subtil în transmisia sinaptică inhibitoare (Ho și colab., 2003). De asemenea, nu a fost raportată nicio analiză sinaptică pentru eliminările CASK care mor la naștere din cauza defectelor liniei medii (Laverty și Wilson, 1998).
Mai multe molecule care mediază dezvoltarea sinapselor au fost identificate prin studii genetice de nevertebrate. De exemplu, mutația C. elegans syd-2 dispersează zonele active presinaptice (Zhen și Jin, 1999). Un defect structural similar apare la muștele lipsite de Drosophila melanogaster syd ortolog liprin-α, care prezintă o scădere concomitentă a transmisiei sinaptice (Kaufmann și colab., 2002). Liprin-α se leagă de o proteină receptor tirozin fosfatază, Dlar (Serra-Pages și colab., 1998), sugerând un model prin care liprin-α și Dlar cooperează pentru a organiza zone active presinaptice. Modul în care liprin-α se leagă de mașinile veziculelor sinaptice rămâne incert.
Pentru a defini rolurile esențiale pentru complexul MALS la mamifere, am purificat complexul MALS din creier. Izolarea complexului MALS a relevat o asociere cu o familie de molecule de adeziune cito-scheletice și presinaptice. Important, am găsit liprin-α1, -α2, -α3 și -α4 în complexul MALS. Asocierea cu acest complex este mediată prin domeniile SAM în liprin-α și o regiune terminală NH2 în CASK. Folosind domeniile motivului α steril (SAM) ale liprinei-a ca negativ dominant, am perturbat complexul MALS-liprin din neuronii disociați. Pentru a înțelege funcția complexului MALS, am generat șoareci mutanți care nu au toate cele trei gene MALS. Șoarecii lipsiți de o singură genă au fost viabile și fertili. Cu toate acestea, șoarecii care nu au toate cele trei gene MALS au murit în decurs de o oră de la naștere. Această letalitate perinatală este asociată cu funcția presinaptică afectată, reflectând deficitele presinaptice ale nevertebratelor lipsite de ortologi liprin-α. Aceste studii stabilesc un rol crucial pentru complexul MALS în exocitoza veziculei sinaptice și implică liprina-α în acest proces.
Rezultate
Caracterizarea proteomică a complexului MALS din creier
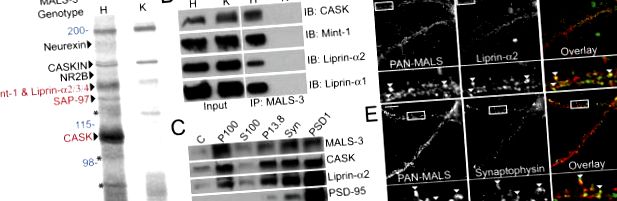
Pentru a identifica rolurile moleculare pentru MALS, am evaluat compoziția complexului proteic MALS. Am efectuat imunoprecipitarea preparativă a MALS-3 din omogenizații cerebrali și am folosit șoareci knock-out MALS-3 (Fig. S1, disponibil la http://www.jcb.org/cgi/content/full/jcb.200503011/DC1) ca un puternic Control. O serie de benzi proteice au fost prezente în imunoprecipitarea MALS-3, care au fost absente în precipitații de la eliminările MALS-3. Au fost identificate mai multe componente cunoscute ale complexului MALS-3, inclusiv neurexină, CASKIN, receptorul NMDA 2B, Mint-1 și PALS-1, care este o proteină asociată cu lin-7 (Fig. 1 A). Colorarea cu argint a imunoprecipitaților a prezentat benzi specifice la 140, 120 și 105 kD (Fig. 1 A). Spectrometria de masă a indicat faptul că banda de 105 kD corespunde CASK, banda de 120 kD corespunde SAP-97, iar banda de 140 kD conținea Mint-1, precum și liprin-α2, -α3 și -α4 (Fig. 1 A). Western blot a confirmat coimmunoprecipitarea eficientă a CASK, Mint-1 și liprin-α1 și -α2 (Fig. 1 B).
Identificarea unui complex proteic neuronal care conține MALS și liprin-α. (A) Imunoprecipitarea MALS-3 din extracte din creier a arătat o serie de benzi în heterozigoti (H) care erau absente din eliminarea MALS-3 (K). Benzile au fost identificate prin MS/MS obținute folosind o sursă de micro-ioni de pulverizare atașată la un spectrometru de masă (roșu) și confirmată prin Western blot (negru). Greutățile moleculare sunt prezentate în albastru, iar produsele de degradare Mint-1 sunt prezentate cu asteriscuri. (B) Western blot de heterozigoți și extracte de creier knockout imunoprecipitate pentru MALS-3 arată o asociere specifică de CASK, Mint-1, liprin-α1 și -α2 cu MALS-3. (C) Western blot arată că MALS-3, CASK și liprin-α2 sunt foarte îmbogățite cu sinaptofizină (Sinfie) în fracția sinaptozomică (Sin) și PSD-95 în fracțiile PSD. (D și E) Culturile de hipocamp (28 DIV) au fost colorate pentru MALS, liprin-α2 și sinaptofizină. Imunomarcarea arată că atât liprin-α2 (D), cât și sinaptofizina (E) se colocalizează parțial cu MALS (vârfuri de săgeți). Bară, 20 μm.
Interacțiunea liprin-α cu complexul MALS
Mutanții liprin-α din D. melanogaster (și mutanții syd în C. elegans) prezintă afectarea exocitozei veziculelor sinaptice. Descoperirea noastră că liprin-α se leagă de complexul MALS - CASK este nouă. În concordanță cu aceasta, MALS, CASK și liprin-α2 au fost îmbogățite în fracții sinaptice biochimice din extracte din creier (Fig. 1 C). Mai mult, MALS este parțial colocalizat cu liprin-α2 și markerul presinaptic sinaptofizină în neuronii hipocampici cultivați (Fig. 1, D și E).
Proteinele Liprin-α conțin regiuni conservate în spirală, trei domenii SAM și o regiune terminală COOH care se leagă de anumite domenii PDZ (Fig. 2 B). Folosind analiza de imunoprecipitare și sistemul cu doi hibrizi de drojdie, am constatat că MALS-1 nu se leagă direct de liprin-α2 (Fig. 2, A [stânga sus] și C). Prin urmare, am întrebat dacă alte componente de bază ale complexului MALS s-ar putea asocia direct cu liprin-α2. Într-adevăr, CASK, dar nu Mint-1, legat direct de liprin-α2 (Fig. 2 A, stânga jos și dreapta sus). Mai mult, am constatat că CASK poate lega liprina-α2 de un complex MALS-1 (Fig. 2 A, în dreapta jos). Aceste asociații biochimice redirecționează, de asemenea, distribuția proteinelor în celulele transfectate și toate cele trei izoforme MALS se pot asocia cu CASK pentru a forma complexe MALS - CASK - liprin-α (Figurile 1 și 2; 2; date nepublicate).
Cartarea domeniului interacțiunii MALS - liprin-α. (A) CASK, dar nu MALS-1 sau Mint-1, liprin-α2 coimmunoprecipitat în celulele COS transfectate. În prezența CASK, MALS liprin-α2 coimmunoprecipitat. (B) Scheme reprezentând domeniile structurale ale MALS-3 (albastru), CASK (portocaliu) și liprin-α2 (galben). (C) Prin analiza cu două hibrizi de drojdie, CASK, dar nu MALS-3, a interacționat cu liprin-α2. Pentru legarea CASK - liprin-α, domeniul SAM1 al liprinei-α2 este suficient pentru interacțiunea cu CASK. Atât domeniul asemănător CaMK, cât și primul domeniu L27 al CASK au fost necesare pentru legarea de liprin-α2.
Pentru a defini site-ul pentru interacțiunea dintre liprin-α2 și CASK, am folosit sistemul cu două hibrizi de drojdie. Am constatat că CASK de lungime completă este ușor legat de liprin-α2 de lungime completă (Fig. 2 C). Această legare a fost mediată în mod specific de primul domeniu SAM în liprin-α2. Analiza de ștergere a CASK a arătat că kinaza CAM (CaMK) și primul domeniu L27 al CASK erau necesare pentru legare. Nu am reușit să mapăm această interacțiune în continuare, sugerând că domeniul de legare poate necesita secvențe mari pentru plierea corectă.
Întreruperea țintită a MALS-3 și reproducerea șoarecilor cu deficit de MALS
Pentru a examina rolurile esențiale pentru MALS în acest complex, am vizat întreruperea MALS-3. Vectorul nostru de direcționare a înlocuit exonii 3, 4 și 5 din MALS-3 cu o casetă de neomicină (Fig. S1, A - C). După întreruperea țintită a celulelor stem embrionare, am generat șoareci deficienți MALS-3. Șoarecii mutanți MALS-3 s-au născut la raporturile mendeliene așteptate și nu au prezentat anomalii comportamentale evidente. Western blot a arătat o absență completă a proteinei MALS-3 în eliminare (Fig. S1 D). Inspecția histologică a creierului nu a arătat anomalii anatomice grave. După cum sa raportat anterior (Misawa și colab., 2001), MALS-3 apare difuz în numeroase populații neuronale din creier (Fig. S1 E). Mai mult, expresia MALS-3 este reglată în sus, în special în regiunea giratorie dentată a hipocampului, la șoarecii dublu knock-out MALS-1/2 (Fig. S1 E).
Am încrucișat șoareci knockout MALS-3 cu mutanții generați anterior MALS-1/2, care au dat 27 de genotipuri posibile. Aceste genotipuri compuse sunt prezentate în Fig. 3 A. Am constatat că majoritatea șoarecilor lipsiți atât de MALS-1 cât și de -3 au murit la scurt timp după naștere, în timp ce șoarecii lipsiți de MALS-1 și -2 erau viabile și fertili. Șoarecii lipsiți de MALS-2 și -3 și heterozigoți pentru MALS-1 au murit în a doua săptămână postnatală. În cele din urmă, șoarecii lipsiți de toate cele trei izoforme MALS au prezentat respirație neregulată și au murit în decurs de o oră de la naștere. Absența completă a MALS nu este asociată cu letalitatea embrionară, deoarece raportul mendelian prezis de făt a fost găsit atunci când a fost efectuată o secțiune cezariană în ziua embrionară 18 (Fig. 3 B).
Generație de șoareci lipsiți de toate cele trei izoforme MALS. (A) Genotiparea PCR a șoarecilor MALS. Un singur asterisc indică șoarecii care au murit în câteva ore de la naștere, iar asteriscul dublu indică o linie care a murit în a doua săptămână postnatală. (B) Statistici obținute din încrucișarea șoarecilor MALS-1/2 K și MALS-3 H. Genotiparea șoarecilor vechi de 2 săptămâni nu a prezentat șoareci TKO. Cu toate acestea, șoarecii embrionari (E18) au arătat raportul prezis de șoareci W, H și K.
Întreruperea complexului MALS - CASK - liprin-α
Șoarecii MALS triple knockout (TKO) apar din punct de vedere anatomic normal la naștere; cu toate acestea, moartea lor perinatală și dificultățile de respirație sugerează deficite neurologice. Pentru a evalua dacă componentele complexului MALS sau ale altor proteine sinaptice prezintă diferențe de expresie cantitativă, am efectuat Western blot la șoarecii MALS TKO în comparație cu șoarecii knock-out MALS-1/2, care erau fenotip normal sau de tip sălbatic (WT). Am constatat că nivelurile CASK au scăzut dramatic în MALS TKO, în timp ce nivelurile tuturor celorlalte proteine sinaptice testate au fost normale la șoarecii TKO (Fig. 4, A și B). De asemenea, am constatat că localizarea sinaptică a CASK, dar nu și alți markeri sinaptici, a fost parțial perturbată în culturile neuronale TKO (Fig. 4, C și D).
Expresia CASK este redusă la șoarecii cu deficit de MALS. (A) Creierele de la șoareci E18 au fost imunoblotate pentru numeroase proteine sinaptice. (B) CASK a fost semnificativ redus (31% din martie ± 8; *, P 90% din neuroni au fost infectați și că nici virusul, nici GFP nu au afectat distribuția MALS (Fig. 5 A). Cu toate acestea, expresia liprinei dominante) negativ (GFP-SAM) a direcționat greșit MALS către site-uri non-sinaptice și a perturbat semnificativ localizarea sinaptică a MALS (Fig. 5 B). - Complex CASK.
- IPhone 6 Slimming Down pentru data de lansare septembrie; Parteneri de canal
- Ultima versiune Suplimentele pentru pastile de slăbit din China - Global Study UK
- Louise la DUNGANNON, complexul de afaceri Ballysaggart - Dungannon, județul Tyrone Slimming World
- Kremlinul ordonă Belarusului să elibereze presupușii mercenari ruși
- Semnalizare multimodală în Broasca Torrent Mică (Micrixalus saxicola) într-un sistem acustic complex