Abstract
fundal
Compoziția microbiotei intestinale pare a fi un factor important în determinarea rezultatului clinic la copiii cu sindromul intestinului scurt (SBS). Modificările microbiotei pot duce la complicații grave, cum ar fi supraaglomerarea bacteriană a intestinului subțire (SBBO) și inflamația mucoasei intestinale care duc la dependență prelungită de nutriție parenterală (PN), cu un risc crescut ulterior de insuficiență hepatică și sepsis. Până în prezent, nu sunt raportate mapări ale microbiomului intestinal la copiii cu SBS. Aici, vă prezentăm primul raport privind profilul comunității microbiene intestinale la copiii cu SBS.
Constatări
Studiul include copiii diagnosticați cu SBS în perioada neonatală. Frații sănătoși au servit drept controale. Probele fecale au fost colectate și profilurile microbiene au fost analizate utilizând secvențierea genei 16S rRNA pe platforma Illumina MiSeq. Am observat o disbioză microbiană pronunțată la copiii cu SBS în tratamentul PN cu o abundență relativă crescută și total dominantă de Enterobacteriacae la patru din cinci copii comparativ cu copiii cu SBS înțărcați din PN și frați sănătoși.
Concluzii
Scăderea generală a diversității bacteriene la copiii cu SBS este în concordanță cu cartografierile microbiomului intestinal în bolile inflamatorii intestinale, cum ar fi boala Crohn și enterocolita necrozantă la sugarii prematuri. Descoperirile noastre indică faptul că disbioza intestinală la copiii cu SBS este asociată cu o dependență prelungită de PN.
Constatări
fundal
Insuficiența intestinală pediatrică (IF) a fost definită ca incapacitatea tractului gastro-intestinal de a susține o creștere adecvată, hidratare și homeostazie electrolitică la copiii fără nutriție parenterală (PN). Sindromul intestinului scurt (SBS) este cea mai frecventă cauză a IF pediatrică. Afecțiunea este cauzată de rezecții masive ale intestinului subțire cauzate de enterocolită necrotizantă (NEC) sau volvulus și de malformații congenitale, cum ar fi gastroschisis și atrezie jejunală. SBS neonatal este o boală cu o morbiditate și mortalitate ridicată [1]. Managementul medical al SBS își propune să stabilească hrănirea enterală/orală completă și înțărcarea din PN.
Microbiota intestinală pare a fi un factor major în determinarea rezultatului clinic de succes în SBS definit ca independență a tratamentului PN și a adaptării intestinale. Modificările microbiotei pot duce la complicații grave, cum ar fi supraaglomerarea bacteriană a intestinului subțire (SBBO) și inflamația mucoasei intestinale care pot preveni înțărcarea din PN prin compromiterea funcțiilor de absorbție intestinală [2,3]. Tratamentul pe termen lung cu antibiotic luminal/oral a fost recomandat pentru SBBO la copii [4,5]. Majoritatea cazurilor de SBS apar la nou-născuți într-o perioadă în care intestinele sterile sunt în mod normal colonizate de bacterii, atingând un profil microbian caracteristic tractului gastrointestinal adult în jurul vârstei de 2 până la 4 ani [6]. O perturbare a comunității microbiene intestinale echilibrate, adică disbioză, cu o abundență relativă crescută de anaerob facultativ Enterobacteriaceae în intestinul gros se observă în boala inflamatorie a intestinului (IBD) la modelele de șoareci, la omul cu boala Crohn și în NEC la sugarii prematuri [7,8].
Până în prezent, nu sunt raportate mapări ale microbiotei intestinale la copiii cu SBS. Aici, prezentăm primul raport privind profilul microbian la copiii cu SBS, utilizând secvențierea genei 16S rRNA pe platforma Illumina MiSeq.
Metode
Pacienți
Acest studiu a fost aprobat de comitetul regional pentru etica cercetării medicale din Uppsala (Dnr2012/002). Părinții au obținut consimțământul scris și informat pentru colectarea probelor și analizele ulterioare. Caracteristicile grupului de studiu și ale fraților sănătoși corespunzători sunt demonstrate în tabelul 1. Studiul include 11 copii cu vârste cuprinse între 1,5 și 7 ani diagnosticați cu IF/SBS în perioada neonatală, dintre care doi provin dintr-un set de triplete (2A și 3A) (Tabelul 1). Toți copiii, cu excepția unuia, s-au născut prematur. Copiii 1A, 8A și 13A au fost supuși unei proceduri de prelungire a intestinului cu enteroplastie transversală în serie (STEP) [9]. Cinci copii nu erau înțărcați din PN în momentul studiului. Șapte frați sănătoși au servit drept controale. Copiii cu PN au avut un aport oral și/sau enteral de formulă proteică hidrolizată fără lactoză și un aport adecvat vârstei de alimente solide cu reducere a conținutului de dizaharide conform Tabelului 1.
Colectarea datelor și analiza statistică
Probele fecale au fost colectate și depozitate la -80 ° C până la analiză. ADN-ul a fost extras din fiecare probă fecală cu un kit de izolare a ADN-ului fecal ultra-curat (MoBio, Naxo Ltd, Tartu, Estonia) conform instrucțiunilor producătorului.
Rezultate
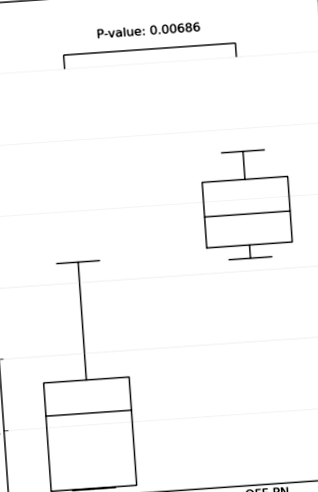
Figura 1 arată că indicele diversității Shannon este redus semnificativ la copiii cu SBS încă în PN comparativ cu copiii înțărcați din PN. Niciunul dintre copiii din PN nu a rămas ICV.
Indicele diversității Shannon la copiii cu SBS încă în PN comparativ cu copiii înțărcați din PN.
Comunități microbiene la copii cu SBS pe PN (1A, 3A, 8A, 9A, 12A), copii SBS înțărcați din PN (2A, 4A, 11A, 13A, 16A, 18A) și frați (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2). Cifra arată abundența relativă a celor mai comune 19 familii taxonomice, care reprezintă cel puțin 84% din abundența din toate eșantioanele.
În Figura 3, indicii diversității Shannon și, în Figura 4, distanțele UniFrac neponderate la copii cu SBS pe PN (1A, 3A, 8A, 9A, 12A), copii SBS înțărcați din PN (2A, 4A, 11A, 13A, 16A, 18A) și frații (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2) sunt comparate.
Indicele diversității Shannon la copii cu SBS pe PN (1A, 3A, 8A, 9A, 12A), copii SBS înțărcați din PN (2A, 4A, 11A, 13A, 16A, 18A) și frați (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Grafic PCoA care descrie distanța UniFrac neponderată între probe. Distanțele perechi între toate probele sunt proiectate pe un spațiu bidimensional în care axa PC1 descrie cel mai înalt grad de variație. Probele care sunt grupate strâns între ele sunt considerate astfel a împărți o proporție mai mare din arborele filogenetic în comparație cu probele care sunt mai separate.
Am avut ocazia unică de a studia tripletele reprezentând toate cele trei grupuri. Copilul 2A și copilul 3A au fost triplete masculine născute la 23 de săptămâni de gestație. Ambii băieți au suferit de NEC în perioada neonatală, rezultând rezecții ale intestinului subțire (Tabelul 1). Al treilea băiat triplet (2C2) a rămas sănătos. La copilul 2A, doar 2 cm din intestinul subțire au fost rezecate, totuși a dezvoltat IF după NEC extins și a devenit dependent de PN. În timpul tratamentului PN, nu avea semne de SBBO. A fost înțărcat până la hrănire orală completă și fără antibiotice cu 3 luni înainte de momentul prelevării de probe fecale. Diversitatea sa bacteriană intestinală a fost similară cu fratele său sănătos (SDI 4, 67 și respectiv 4, 97).
Copilul 12A a fost tratat cu antibiotice numai în primele 2 săptămâni postnatal, nu a avut semne de SBBO și înțărcarea din PN a avansat, dar lent. Sa arătat diversitatea ei bacteriană fecală Lactobacillacae ca cea mai relativă familie taxonomică abundentă în conformitate cu constatările noastre anterioare (Figura 2) [13]. Am putea detecta Clostridium difficile la doi din zece pacienți cu SBS (pacientul 2A și 11A) și cu abundență relativă foarte mică (datele nu sunt prezentate).
Concluzii
Tendința ca SBBO și inflamația intestinului să întârzie sau să prevină înțărcarea din PN la acești copii cu SBS pare să fie legată de disbioza microbiană în tractul intestinal. Această constatare este în conformitate cu un studiu anterior care demonstrează că administrarea PN a fost asociată independent cu SBBO [14]. Influența PN asupra modificării profilului din cauza înfometării microbiomului este puțin probabilă, deoarece malabsorbția nutriției orale/enterale este problema majoră în SBS. În general, modificările observate ale microbiotei la copiii SBS sunt cel mai probabil atât la cauza, cât și la o consecință a stării bolii copilului. Limita studiului este grupul mic de studiu, iar factorii de confuzie care ar putea influența rezultatele sunt vârsta, lungimea intestinală și tratamentul cu antibiotice. Cu toate acestea, cohorta din prezentul studiu reprezintă copiii cu SBS în practica clinică.
În centrul nostru, tratăm SBBO cu antibiotice orale, așa cum recomandă alte centre [4-6]. Cu toate acestea, este cel mai probabil ca antibioticele să contribuie și mai mult la disbioză la acești copii. La copiii cu SBS, colonizarea normală este întreruptă din cauza utilizării precoce și frecvente a antibioticelor, iar diversitatea bacteriană redusă permite extinderea potențialelor bacterii patogene. S-a sugerat că antibioticele scad rezistența la colonizare împotriva Enterobacteriacae ca Escherichia coli și Salmonella enterica, prin creșterea tonusului inflamator al mucoasei intestinale [15]. Cel mai frecvent, probioticele sunt utilizate pentru a modifica microbiota intestinală în SBS; cu toate acestea, există constatări și rapoarte contradictorii privind septicemia asociată cu probiotice [16].
Scăderea generală a diversității bacteriene la copiii noștri cu SBS este în concordanță cu disbioza intestinală la pacienții cu IBD, sugari cu NEC și a fost descrisă și într-un model de purcei de SBS [7,8,17,18]. În plus, copiii cu recurență C. difficile-diareea asociată prezintă o diversitate fecală scăzută cu o reducere a Bacteriodete și Firmicute [19]. La acești copii, transplantul de microbiote fecale (FMT) are o rată de succes mai mare de 90%. Un astfel de tratament a fost, de asemenea, utilizat cu succes ca o completare pentru tratarea IBD [19,20]. În consecință, FMT s-ar putea dovedi a fi o alternativă de tratament în cazuri atent selectate de SBS cu disbioză. Cu toate acestea, întrucât copiii cu SBS sunt adesea vulnerabili din cauza stării lor de sănătate inițiale, trebuie luate în considerare dificultățile și riscurile FMT. Deși incidența efectelor secundare severe este rară, un astfel de risc este contractarea bolii de la donator, unde microorganismele asimptomatice care nu cauzează probleme la un donator sănătos pot provoca o reacție la destinatar. În plus, sosirea în masă a unei noi microbiote poate declanșa, de asemenea, boli autoimune, precum și bacterii și șoc septic. De asemenea, ar trebui să se acorde o atenție deosebită în cazul FMT dacă pacientul prezintă vreun semn de imunodeficiență [21].
Acesta este primul raport care descrie profilul microbian intestinal la copiii cu SBS utilizând secvențierea de generația următoare. Am observat o disbioză microbiană pronunțată la copiii cu SBS încă în PN comparativ cu copiii înțărcați din PN cu o abundență relativă crescută de proteobacterii, dintre care majoritatea au fost tratați pe termen lung cu antibiotice. Descoperirile noastre indică faptul că disbioza intestinală la copiii cu SBS este asociată cu un rezultat afectat cu dependență prelungită de PN. Studiile viitoare trebuie să afle noi strategii pentru tratarea disbiozei intestinale la acești copii.
- Disbioza microbiotei intestinale este asociată cu malnutriția și nivelurile reduse de aminoacizi din plasmă
- Numărul mai mare de trombocite este asociat cu sindromul metabolic independent de diagnosticul ficatului gras
- Cum să ne hrănim copiii fără alimente, calorii și reguli
- Ceaiul verde ca inhibitor al absorbției intestinale a lipidelor Mecanismul potențial al acestuia
- SCRISOARĂ Ar trebui să dăm vina pe părinți pentru copiii supraponderali Opinii despre perspective locale Telegrama