Eric Stice
1 Departamentul de Psihologie, Universitatea din Texas, Austin, Texas 78712,
Sonja Yokum
1 Departamentul de Psihologie, Universitatea din Texas, Austin, Texas 78712,
Kenneth Blum
2 Departamentul de Psihiatrie, Universitatea din Florida Colegiul de Medicină și McKnight Brain Institute, Gainesville, Florida 32611 și
Cara Bohon
3 Departamentul de Psihiatrie, Universitatea din California, Los Angeles, Los Angeles, California 90095
Abstract
În concordanță cu teoria conform căreia persoanele cu circuite de recompensă hipofuncționale supraalimentează pentru a compensa un deficit de recompensă, oamenii obezi față de cei slabi au mai puțini receptori striatali D2 și prezintă un răspuns mai puțin striat la aportul de alimente plăcut. Răspunsul striatal scăzut la consumul de alimente prezice creșterea în greutate viitoare la cei cu risc genetic pentru semnalizarea redusă a circuitelor de recompensă pe bază de dopamină. Cu toate acestea, studiile pe animale indică faptul că aportul de alimente plăcute are ca rezultat reglarea redusă a receptorilor D2, sensibilitatea redusă D2 și sensibilitatea redusă a recompensei, ceea ce implică faptul că supraalimentarea poate contribui la o reacție striată redusă. Astfel, am testat dacă supraalimentarea duce la o reacție striată redusă la consumul de alimente plăcute la om, utilizând imagistica prin rezonanță magnetică funcțională cu măsuri repetate. Rezultatele au indicat faptul că femeile care s-au îngrășat pe o perioadă de 6 luni au arătat o reducere a răspunsului striatal la consumul de alimente plăcute comparativ cu femeile cu greutate stabilă. Colectiv, rezultatele sugerează că sensibilitatea redusă a circuitelor de recompensă crește riscul de supraalimentare și că această supraalimentare poate atenua și mai mult reacția circuitelor de recompensă într-un proces de avans.
Introducere
Striatul joacă un rol cheie în codificarea recompensei din aportul de alimente. Hrănirea este asociată cu eliberarea de dopamină (DA) în striatul dorsal și gradul de eliberare a DA se corelează cu cantitatea de plăcere de la mâncare (Szczypka și colab., 2001; Small și colab., 2003). Striatul dorsal răspunde la ingestia de ciocolată la omul slab și este sensibil la devalorizarea acesteia prin hrănirea dincolo de sațietate (Small și colab., 2001).
Oamenii obezi prezintă o disponibilitate mai mică a receptorilor D2 striatali decât oamenii slabi (Wang și colab., 2001; Volkow și colab., 2008), iar șobolanii obezi au niveluri de DA bazale mai mici și disponibilitate redusă a receptorului D2 decât șobolanii slabi (Orosco și colab., 1996; Fetissov și colab., 2002). Oamenii obezi versus slabi prezintă o activare mai mică a regiunilor țintă DA striatale (caudat, putamen) ca răspuns la consumul de alimente plăcute (Stice și colab., 2008a, b), dar prezintă o activare striatală mai mare ca răspuns la imaginile cu mâncare (Rothemund și colab., 2007; Stoeckel și colab., 2008; Stice și colab., 2010), sugerând o disociere între recompensa alimentară consumatoare și evidențierea stimulativă a indicilor alimentari. În mod critic, oamenii care au prezentat o activare striatală mai slabă ca răspuns la consumul de alimente care au avut o alelă A1 TaqIA, care este asociată cu o disponibilitate mai mică a receptorului striatal D2 (Noble și colab., 1991; Ritchie și Noble, 2003; Tupala și colab., 2003) și reducerea metabolismului striatal în repaus (Noble și colab., 1997), au prezentat creșteri în greutate viitoare crescute (Stice și colab., 2008a). În mod colectiv, aceste descoperiri sunt în concordanță cu teoria conform căreia indivizii cu o capacitate de semnalizare mai mică în circuitele de recompensă supraalimentează pentru a compensa acest deficit de recompensă (Blum și colab., 1996; Wang și colab., 2002).
Cu toate acestea, există dovezi că consumul de alimente gustoase duce la reducerea reglementării semnalizării DA. Aportul regulat de alimente bogate în grăsimi și cu conținut ridicat de zahăr care are ca rezultat creșterea în greutate duce la reducerea reglării receptorilor D2 postsinaptici, sensibilitate scăzută la D2 și sensibilitate redusă la recompense la rozătoare (Colantuoni și colab., 2001; Bello și colab., 2002; Kelley și colab., 2003; Johnson și Kenny, 2010). Deoarece aceste date implică faptul că supraalimentarea poate contribui la o atenuare suplimentară a reacției striatale la alimente, am efectuat un studiu prospectiv cu imagini prin rezonanță magnetică funcțională (IRMF) pentru a testa în mod direct dacă supraalimentarea este asociată cu o activare striatală redusă ca răspuns la alimentele gustoase din oameni.
Materiale și metode
Participanți
Participanții au fost 26 de femei tinere supraponderale și obeze (vârsta medie, 21,0 ± 1,11 ani; indicele mediu de masă corporală [IMC], 27,8 ± 2,45). Eșantionul a constat din 7% asiatici/insulelor din Pacific, 2% afro-americani, 77% europeni americani, 5% nativi americani și 9% moștenire rasială mixtă. Participanții au acordat acordul scris. Panoul local de evaluare a eticii a aprobat acest studiu. Au fost excluși cei care au raportat comportament excesiv sau comportamente compensatorii în ultimele 3 luni, utilizarea curentă a medicamentelor psihotrope sau a drogurilor ilicite, leziuni ale capului cu pierderea cunoștinței sau tulburarea psihiatrică actuală a Axei I. Datele au fost colectate la momentul inițial și la o monitorizare de 6 luni.
Măsuri
Masa corpului.
IMC (kg/m 2) a fost utilizat pentru a reflecta adipozitatea (Dietz și Robinson, 1998). După îndepărtarea pantofilor și paltoanelor, înălțimea a fost măsurată la cel mai apropiat milimetru folosind un stadiometru și greutatea a fost evaluată la cel mai apropiat 0,1 kg folosind o cântare digitală. Au fost obținute și calculate în medie două măsuri. Participanții au fost rugați să se abțină să mănânce timp de 3 ore înainte de a finaliza măsurile antropomorfe în scopul standardizării. IMC se corelează cu măsurătorile directe ale grăsimii corporale totale, cum ar fi absorptiometria cu raze X cu energie dublă (r = 0,80-0,90) și cu măsurile de sănătate, cum ar fi tensiunea arterială, profilurile lipoproteice adverse, leziunile aterosclerotice, nivelul seric al insulinei și diabetul zaharat (Dietz și Robinson, 1998).
paradigma fMRI.
Participanții au fost rugați să își consume mesele obișnuite, dar să se abțină de la a mânca sau a bea (inclusiv băuturi cu cofeină) timp de 4-6 ore înainte de sesiunea lor de imagistică pentru standardizare. Am selectat această perioadă de deprivare pentru a surprinde starea de foame pe care o experimentează majoritatea indivizilor în timp ce se apropie de următoarea masă, care este un moment în care diferențele individuale în recompensa alimentelor ar avea un impact logic asupra aportului caloric. Participanții au finalizat paradigma între 11:00 și 13:00 sau 16:00 și 18:00. Deși am încercat să efectuăm scanări inițiale și de urmărire în același timp al zilei, din cauza limitărilor de programare, doar 62% dintre participanți au efectuat a doua scanare în decurs de 3 ore de la terminarea scanării inițiale (diferența medie de timp a scanărilor, 3,0 h, interval, 0,5-6,0 h). Participanții au fost familiarizați cu paradigma fMRI prin practică pe un computer separat înainte de scanare.
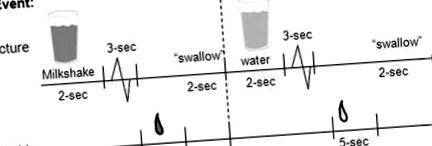
Exemplu de sincronizare și ordonare a prezentării imaginilor și băuturilor în timpul alergării.
Colectorul gustativ era ancorat la masă. Au fost utilizate tuburi noi și seringi pentru fiecare subiect și piesa bucală a fost curățată și sterilizată între utilizări.
Imagistica și analiza statistică
Scanarea a fost efectuată de un scaner RMN de tip Siemens Allegra 3 tesla. O bobină standard cușcă de păsări a fost utilizată pentru a obține date din întregul creier. O pernă de vid termoizolant și o căptușeală suplimentară au fost utilizate pentru a restricționa mișcarea capului. În total, au fost colectate 152 de scanări în timpul fiecărei runde funcționale. Scanările funcționale au folosit o secvență de imagistică plan echo cu un gradient ponderat T2 * [timp de ecou = 30 ms, timp de repetare (TR) = 2000 ms, unghi de rotație = 80 °] cu o rezoluție în plan de 3,0 × 3,0 mm 2 [ 64 × 64 matrice; 192 × 192 mm 2 câmp vizual (FOV)]. Pentru a acoperi întregul creier, s-au achiziționat 32 de felii (4 mm grosime; achiziție intercalată, fără sărituri) de-a lungul planului transversal AC-PC, oblic, așa cum este determinat de secțiunea mediatagitală. Scanările structurale au fost colectate utilizând o secvență ponderată de recuperare inversiune T1 (MP-RAGE) în aceeași orientare ca secvențele funcționale pentru a furniza imagini anatomice detaliate aliniate la scanările funcționale. Au fost achiziționate secvențe RMN structurale de înaltă rezoluție (FOV = 256 × 256 mm 2, matrice 256 × 256, grosime = 1,0 mm, n ≈ 160 felii).
Datele au fost preprocesate și analizate folosind SPM5 (Wellcome Department of Imaging Neuroscience, Londra, Marea Britanie) și MATLAB (Worsley și Friston, 1995). Imaginile au fost achiziționate în timp corectate la felia obținută la 50% din TR. Imaginile funcționale au fost realiniate la medie. Imaginile anatomice și funcționale au fost normalizate la creierul șablon standard MNI implementat în SPM5 (ICBM152, pe baza unei medii de 152 scanări RMN normale). Normalizarea a dus la o dimensiune a voxelului de 3 mm 3 pentru imaginile funcționale și 1 mm 3 pentru imaginile structurale. Imaginile funcționale au fost netezite cu o lățime completă de 6 mm la jumătatea maximă a nucleului izotrop gaussian.
Pentru a identifica regiunile creierului activate de consumul de alimente plăcute, am contrastat răspunsul dependent de nivelul oxigenării din sânge (BOLD) în timpul primirii milkshake-ului versus primirea soluției fără gust. Am considerat că sosirea unui gust în gură este o recompensă consumatoare, mai degrabă decât atunci când gustul a fost înghițit, dar recunoscând că efectele postestive contribuie la valoarea recompensei alimentelor (O'Doherty și colab., 2002). Efectele specifice condiției la fiecare voxel au fost estimate utilizând modele liniare generale. Vectorii de onsets pentru fiecare eveniment de interes au fost compilate și introduse în matricea de proiectare astfel încât răspunsurile legate de eveniment să poată fi modelate de funcția de răspuns hemodinamic canonic, așa cum a fost implementat în SPM5, constând dintr-un amestec de două funcții gamma care emulează primele atingeți vârful la 5 s și următorul subshoot. Pentru a ține cont de varianța indusă de înghițirea soluțiilor, am inclus timpul variației de control pentru subiectul de înghițire (subiecții au fost instruiți să înghită în acest moment). De asemenea, am inclus derivați temporali ai funcției hemodinamice pentru a obține un model mai bun al datelor (Henson și colab., 2002). A fost utilizat un filtru de trecere de 128 s (conform convenției SPM5) pentru a elimina zgomotul de joasă frecvență și a deriva lent în semnal.
Au fost construite hărți individuale pentru a compara activările din cadrul fiecărui participant pentru chitanța de lapte de contrast - chitanță fără gust. Comparațiile între grupuri au fost apoi efectuate folosind modele cu efecte aleatorii pentru a explica variabilitatea interparticipantă. Estimările parametrilor au fost introduse într-un ANOVA cu efect aleatoriu de nivel 2 × 2 (chitanță cu lapte de lapte - chitanță fără gust) după grupul de creștere în greutate versus grupul stabil în greutate, grupul de creștere în greutate versus grupul de pierdere în greutate sau grupul stabil în greutate versus grup de slăbit. Semnificația activării BOLD a fost determinată luând în considerare atât intensitatea maximă a unui răspuns, cât și amploarea răspunsului. Am efectuat căutări de regiuni de interes (ROI) folosind vârfuri în striatul dorsal identificate anterior (Stice și colab., 2008a) ca centreide pentru a defini sferele cu diametrul de 10 mm. Semnificația pentru aceste ROI a priori a fost evaluată la un prag statistic de p 2 = 0,21-0,42) ca răspuns la primirea de milkshake decât femeile care se așteptau ca mâncarea să fie mai puțin plină de satisfacții.
Rezultate
Am testat dacă subiecții care au prezentat o creștere> 2,5% a IMC în perioada de urmărire de 6 luni (N = 8; procent mediu de modificare a IMC = 4,41; interval, 2,6-8,2) au prezentat o reducere a activării caudatului ca răspuns la consumul de milkshake relativ la cei care au prezentat o scădere de 2,5% a IMC (N = 6; procentaj mediu de modificare a IMC = −4,7; interval, -3,1–6,8) au prezentat o schimbare diferențiată a răspunsului striatal la alimentele plăcute decât participanții care au rămas greutate stabilă sau au câștigat în greutate. În ceea ce privește modificarea greutății brute, aceasta s-a tradus într-o schimbare medie a greutății de 6,4 lbs pentru grupul de creștere în greutate, o schimbare medie a greutății de 0,5 lbs pentru grupul stabil în greutate și o schimbare medie a greutății de -6,8 lbs pentru greutate -grupa de pierdere. Deși grupurile nu au diferit în ceea ce privește IMC la momentul inițial, am controlat această variabilă. Deoarece a existat o oarecare variație în timpul zilei la care au fost efectuate scanările inițiale și de urmărire între subiecți care ar fi putut influența rezultatele, am controlat și diferența de timp a celor două scanări (în ore). Estimări ale parametrilor din milkshake - contrastele fără gust au fost introduse într-un ANOVA cu efect aleatoriu de nivel 2 × 2 × 2 (de exemplu, creștere în greutate - stabilă în greutate după primirea de milkshake - primire fără gust până la urmărirea de 6 luni - linia de bază.
Secțiunea coronară care arată mai puțină activare în caudatul drept (12, −6, 24; Z = 3,44; corectată prin FDR p = 0,03; eliberare de DA indusă de pd-amfetamină în striatul ventral evaluată prin tomografie cu emisie de pozitroni (PET) și activare BOLD evaluat prin fMRI în aceeași regiune în timpul anticipării (pregătirea motorului pentru a obține) a recompensei monetare (r = 0,51), rezultate paralele dintr-un alt studiu PET/fMRI (Schott și colab., 2008). În al doilea rând, nu am efectuat măsurători ale greutății la aceeași oră a zilei pentru participanții la evaluările inițiale și de urmărire de 6 luni, care ar fi putut introduce erori în modelarea schimbării în greutate. Cu toate acestea, am standardizat timpul de la ultima masă solicitând participanților să se abțină de la orice tip de aport de alimente sau băuturi (altele decât apa) timp de 3 ore înainte de a fi cântărite. Am constatat, de asemenea, că IMC a prezentat o testare ridicată de 1 lună - fiabilitatea reevaluării (r = 0,99) într-un studiu anterior care, de asemenea, nu a efectuat măsurători ale greutății la aceeași oră a zilei la momentul inițial și evaluare de urmărire (Stice și colab., 2006). În al treilea rând, nu am putut confirma faptul că participanții s-au abținut de la masă timp de 4-6 ore înainte de scanarea IRMF, ceea ce ar fi putut introduce o varianță inutilă.
În concluzie, rezultatele actuale, luate în combinație cu constatările anterioare, sugerează că o reacție scăzută a circuitelor de recompensă bazate pe DA la consumul de alimente poate crește riscul de supraalimentare și, în plus, această supraalimentare are ca rezultat o atenuare suplimentară a capacității de reacție a circuitelor de recompensă, crescând astfel riscul pentru creșterea în greutate viitoare într-un mod avansat. Acest model de lucru poate explica de ce obezitatea prezintă de obicei o evoluție cronică și este rezistentă la tratament.
Note de subsol
Acest studiu a fost susținut de National Institutes of Health Grants R1MH64560A și DK080760.
- Creșterea în greutate ca răspuns la hrana cu conținut ridicat de grăsimi la șoarecii masculi CD-1 - W L Breslin, K Strohacker, K C
- Pierderea în greutate ca răspuns la lipsa alimentelor prezice măsura obezității induse de dietă în C57BL6J
- Top 10 alimente pentru îngrășare care te fac să te îngrași - Alimente adevărate pentru viață
- Ce cauzează obezitatea 10 produse alimentare care pot provoca creșterea excesivă în greutate
- Înțelegerea distorsiunii porțiunilor și rolul acesteia în pierderea în greutate a siguranței alimentelor; Blog de calitate