Abstract
Lucrarea analizează problemele recente în ceea ce privește înțelegerea bazei genetice și a genei/genei, precum și a interacțiunii genă/mediu în dezvoltarea obezității și a complicațiilor acesteia.
Introducere
În ultimii ani, obezitatea a devenit o problemă majoră de sănătate publică datorită prevalenței sale, care se ridică la peste 25% în anumite țări, cu creșterea alarmantă a copiilor. Mecanismele moleculare responsabile de acumularea și întreținerea masei grăsimilor trebuie încă elucidate. Obezitatea rezultă din interacțiunea factorilor de mediu (dieta cu densitate calorică ridicată și reducerea activității fizice) și a factorilor ereditari. Acest lucru a fost demonstrat de numeroase studii epidemiologice efectuate la populații mari și diferite, care variază etnic (gemeni crescuți împreună sau separat, copii adoptați, familii nucleare etc.) [1-5].
Obezitatea are o expresie fenotipică foarte eterogenă și mecanismele moleculare implicate în dezvoltarea acesteia sunt diverse. Conform mai multor studii, 30-80% din variația greutății ar putea fi atribuită factorilor genetici [1-5]. Astăzi, participarea factorilor genetici la dezvoltarea obezității poate fi rezumată după cum urmează:
mutațiile unice contribuie la dezvoltarea obezității (obezitate monogenă). Aceste forme de obezitate sunt rare, dar foarte severe și, în general, încep din copilărie [6];
mai multe variante genetice interacționează cu un mediu „cu risc” ceea ce duce la dezvoltarea obezității comune (obezitate poligenică).
Forme monogene de obezitate
Obezitatea este rareori cauzată de un singur defect genetic în populația generală [11]. Tabelul 1 prezintă variantele genetice identificate până acum în familiile cu obezitate sau variantele care au fost găsite doar la indivizii obezi [10].
tabelul 1
Gene care cauzează forme monogene de obezitate la om.
| Leptină (LEP) | [12, 13; 14] |
| Receptorul leptinei (LEPR) | [15] |
| Pro-opiomelanocortină (POMC) | [16; 17] |
| Prohormona convertaza-1 (PC1) = Ectonucleotidă pirofosfatază/fosfodiesterază 1 (ENPP1) | [18, 19] |
| Receptorul 1 al hormonului care concentrează melanina (MCHR1) = receptorul cuplat la proteina G 24 (GPR24) | [20] |
| Receptorul melanocortinei-3 (MC3R) | [21] |
| Receptorul melacortinei-4 (MC4R) | [10, 22, 23] |
| Receptorul-1 al hormonului care eliberează corticotropină (CRHR1) | [24] |
| Receptorul hormonal eliberator de corticotropină -2 (CRHR2) | [24] |
| Factorul de transcripție bHLH-PAS (SIM1) | [25, 26] |
Clonarea genei ob la șoarece și omologul său uman, Leptina [27] a oferit primul exemplu de relație cauzală între o mutație și obezitate. Două mutații diferite care perturbă structura genei Leptinei au fost identificate până acum la 6 copii cu obezitate morbidă [12,13,14]. Tratamentul acestor copii cu proteină recombinantă din leptină, greutatea normalizată dramatic, pubertatea, precum și reducerea celor mai multe simptome ale sindromului metabolic [28]. Cu toate acestea, nu este cazul obezității obișnuite, deoarece ambii indivizi demonstrează nivelurile crescute de leptină serică și rezistența la leptină [29,30]. Pentru formele rare de obezitate, au fost identificate mutații ale receptorului melanocortinei (MC4R), iar prevalența lor a fost estimată a fi de până la 2-4% în rândul copiilor obezi [10,34,35,]. Gradul de obezitate la persoanele care suferă de mutația MC4R variază și acești indivizi sunt, de obicei, și mai înalți. O metaanaliză recentă sugerează că alela comună a variantei Val103Ile în regiunea de codificare a MC4R este asociată cu obezitatea, în timp ce alela rară (Ile103) (cu o frecvență de 4%) este mai frecventă la persoanele slabe [36] . S-a constatat că alela Ile103 este asociată și cu un IMC mai mic [37].
Obezitate legată de mutații cromozomiale la scară largă
În plus față de defectele genetice care afectează în principal greutatea corporală, numeroase sindroame care prezintă obezitatea ca unul dintre simptome au fost mapate la anumiți loci cromozomiali, iar pentru unele dintre aceste cazuri a fost identificată gena de bază [10]. Prader-Willi este cel mai frecvent sindrom care afectează la fiecare 16.000-25.000 de nou-născuți pe an [31,32]. Sindromul Prader-Willi este o tulburare de imprimare care este de obicei cauzată de o ștergere a cromozomului moștenit paternal regiunea 15q.
Originea obezității este mai complexă în sindromul Bardet-Biedl (BBS), care se caracterizează prin șase caracteristici principale precum: tija-con-distrofia (cel mai frecvent fenotip), polidactilia, dizabilități de învățare, hipogonadism la bărbați, anomalii renale și obezitate. La pacienții cu BBS, obezitatea apare cu un debut precoce, care apare de obicei în primii câțiva ani de viață. Baza genetică a BBS este de obicei autosomală recesivă, cu toate acestea, apariția moștenirii trialelice a fost sugerată în unele familii [77].
Fundalul genetic al formelor comune de obezitate
Primele dovezi că genetica este importantă în obezitatea comună, non-sindromică, au provenit dintr-un studiu care a fost publicat în urmă cu aproape 30 de ani. În 1977, Institutul Național al Inimii, Plămânilor și Sângelui (NHLBI) Twin Study a indicat mai întâi posibilitatea ca agregarea familială observată pentru obezitate să se fi datorat mai mult factorilor genetici decât mediului [78].
Ulterior, în 1986, Stunkard a folosit 1.974 de perechi gemene monozigotice și 2.097 dizigotice și a estimat o valoare de ereditate pentru greutate de 0,78, care a crescut la 0,81 după urmărirea de 25 de ani [2]. Aceste valori au fost similare cu valoarea de eritabilitate de 0,80 pentru înălțime, estimată în același studiu.
Un studiu privind adopția copiilor a arătat în același timp rezultate similare în sprijinul unei influențe genetice asupra greutății corporale, copiii adoptați având dimensiuni ale corpului mai asemănătoare cu cele ale părinților lor biologici decât părinții lor adoptați în întreaga gamă de dimensiuni ale corpului [3]. Aceste studii au fost efectiv combinate într-o lucrare seminală în 1990, care a examinat gemeni identici și frăți care au fost crescuți împreună și separați [4]. Similar studiilor anterioare, au fost raportați coeficienții de corelație intra-pereche pentru fenotipurile obezității de 0,70 la bărbați și 0,66 la femei. Mediul partajat nu părea să aibă niciun efect măsurabil, iar mediul personal non-partajat a contribuit cu aproximativ 30% din varianță (2,4).
Au fost efectuate scanări multiple la nivelul genomului pentru obezitate și trăsături legate de compoziția corpului [10]. De obicei, în tulburările complexe, prima identificare a unei regiuni legate de boală nu duce automat la o replicare într-un studiu de urmărire efectuat într-un alt eșantion de studiu. Cu toate acestea, dovezile legăturii (scor scor> 3.0 sau p Tabelul 2 ilustrează căile în care polimorfismele genetice pot afecta căile fiziologice implicate în reglarea echilibrului energetic, crescând astfel susceptibilitatea la dezvoltarea obezității într-un cadru de mediu dat. Exemple de putative genele candidate sunt date pentru fiecare cale.
masa 2.
Diferite mecanisme prin care se așteaptă ca genetica să joace un rol în dezvoltarea obezității; sunt prezentate exemple de gene candidate putative pentru fiecare categorie. Genele sunt adnotate cu simbolul genetic aprobat (baza de date a nomenclaturii genomului uman). Adaptat de la referințele 9 și 10
| Țesut adipos | ||
| Dezvoltare și acumulare | Diferențierea adipocitelor, acumularea de grăsime | FOXC2, PPARA, PPARD, PPARG, RXRA, RXRB |
| Funcția metabolică | Echilibrul dintre eliberarea lipidelor și acumularea | VLDLR, LIPE, LPL, SCD, UCP2, ADRB1, ADRB2, ADRB3, ADRA2A, ADRA2B, INSR, FABP; CD36 |
| Funcția endocrină | Semnalele de la țesutul adipos la reglarea centrală a echilibrului energetic | LEP, LEPR, NPPA, SPARC, TNF, IL6, AMP1, |
| Aportul de energie | ||
| Central | Neurotransmițători sau receptori hipotalamici | NPY, NPYR, POMC, MC4R, LEPR, CART, 5HT2C, CCKAR, AGRP |
| Periferic | Hormoni sau alți compuși de semnalizare implicați în reglarea apetitului | CCK, APOA-IV, GHRL, PPY, GLP GIP |
| Preferințe alimentare | Preferință pentru dulce, grăsime, aversiune față de anumite fructe și legume datorită sensibilității ridicate la gustul amar. | TAS1R, TAS2R |
| Consum de energie | ||
| Central | Neurotransmițători sau receptori hipotalamici | MC4R, Dopamina 2R, NPYR |
| Mediator | Sistem simpato-adrenergic | ADRB1, ADREB2, ADRB3, ADRA2A, ADRA2B |
| Efectori | EE ca atare, oxidarea grăsimilor | UCP1, UCP2, UCP3 |
Polimorfismul genei promovează complicațiile metabolice legate de obezitate
Pe lângă gene - restricții de reglare a aportului caloric (pofta de mâncare), au fost identificate numeroasele variante genetice care aspect contribuie la variații ale metabolismului lipidic, termogeneza, diferențierea țesutului adipos, procesul imuno-inflamator, rezistența la insulină/predispunerea la diabet, tromboembolism etc. . Exemple de astfel de gene sunt date în Tabelul 3 .
Tabelul 3.
Exemple de gene cu variații comune asociate cu tulburări metabolice legate de obezitate. Adaptat de la referințele 54, 55, 9 și 10
| Ateroscleroza | ||
| Transportul și metabolismul lipidelor | Concentrația plasmatică a lipopoproteinelor, eficacitatea inversă a transportului colesterolului | APOA-I, APOA-II, APO-AIV, apo (a), APOB, APOC-II, APOC-III, APOC-IV, APOD, APOE, APOH, APOJ, CETP, PLTP, MTP, FATPI, FABP2, LDLR, LRP, SR-BI, VLDLR, LPL, HL, LCAT, PON1, PON2, ABCA1 |
| Hipertensiune | ||
| Sistemul renină-angiotensină | Angiotensina II; vasoconstricție | AGT, ACE, CYP11B2 |
| Transportul/metabolismul de sodiu | Retenție de sodiu | EnaC, adducină, 11b-hidroxisteroid dehidrogenază |
| G-proteine | Activitatea receptorilor legați de G | GNAS1, receptori adrenergici |
| Factori asociați endoteliului | Disfuncție endotelială | iNOS, eENOS, tPA, PAI, VEGF |
| Hemostază/tromboză | ||
| Glicoproteine din suprafața trombocitelor | Aderența și agregarea trombocitelor | Glicoproteina Ia, Ib |
| Factori de coagulare | Tromboembolism | Fibrinogen, protrombină, factor V, factor VII, factor VIII, factor IX, factorXII, factor XIII, trombomodulină |
| Sistem trombolitic | Tromboliză defectă | tPA, PAI-I |
| Diabetul de tip 2 | ||
| Regulatori ai metabolismului energetic | Factori de transcriere | PPARA, PPARG, HNF1A, HNF4A; m-Tor |
| Insulină | Proteine și receptori | Adiponectină, KCNJ11, CAPN10, TCF1, IRS1 |
| sensibilitate/rezistență | ||
| Inflamaţie | ||
| Factori de inflamație | Exprimat în adipocite și celule sanguine | TNFa, TNFb, TGFb1, TGFb2, IL1, IL1ra, CD14, P-selectină, E-selectină, PCAm-1 |
Interacțiunea genă-genă într-un model poligenic al obezității
Cealaltă metodă - analiza cluster, similar analizei componente principale, prezintă nu numai bazele principale de gene, ci și ierarhia cu semnificație fiziologică diferită [76,77,78].
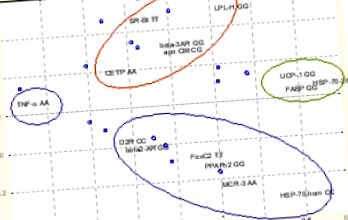
Figura 1 și Figura 2 prezintă exemplele de utilizare a ambelor: analiza PC, precum și analiza cluster în studiul nostru. Este dată o aplicație pentru analiza celor mai populare 14 trăsături genetice și a caracteristicilor sale fenotipice înregistrate în timpul studiului obezității în Polonia de Sud. (rezultatele noastre, Journal of Clin Chem Lab Med 2007 în presă).
Analiza componentelor principale separă trăsăturile genetice în funcție de asemănările sale în formarea fenotipului
- Efectul obezității genetice și dietetice asupra gestionării sulfului de către șobolan - ScienceDirect
- Descoperită legătura genetică între obezitate și singurătate - BioNews
- Scuza genetică pentru obezitate este un mit
- Controlul genetic al rolului lipogenezei de novo în obezitatea indusă de dietă Critical Reviews in
- Testele genetice pentru riscul de obezitate sunt scurte în comparație cu IMC - Diabetul