Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center
Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center
Laborator de reglare celulară și carcinogeneză, CHA Cancer Research Institute, CHA Medical School, Seoul, Coreea
Laboratorul de Medicină Translațională, Universitatea de Medicină și Științe Gachon Lee Gil Ya Cancer and Diabetes Institute, Incheon
Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center
Laboratorul de Medicină Translațională, Universitatea de Medicină și Științe Gachon Lee Gil Ya Cancer and Diabetes Institute, Incheon
Ki - Baik HAHM, Laboratorul de Medicină Translațională, Universitatea de Știință și Medicină Gachon, Institutul Lee Gil Ya pentru Cancer și Diabet și Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center, 7-45 Songdo - dong, Yeonsu - gu, Incheon 406‐840, Coreea. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center
Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center
Laborator de reglare celulară și carcinogeneză, CHA Cancer Research Institute, CHA Medical School, Seoul, Coreea
Laboratorul de Medicină Translațională, Universitatea de Medicină și Științe Gachon Lee Gil Ya Cancer and Diabetes Institute, Incheon
Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center
Laboratorul de Medicină Translațională, Universitatea de Medicină și Științe Gachon Lee Gil Ya Cancer and Diabetes Institute, Incheon
Ki - Baik HAHM, Laboratorul de Medicină Translațională, Universitatea de Știință și Medicină Gachon, Institutul Lee Gil Ya pentru Cancer și Diabet și Departamentul de Gastroenterologie, Gachon Graduate School of Medicine Gil Medical Center, 7-45 Songdo - dong, Yeonsu - gu, Incheon 406‐840, Coreea. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Abstract
ABORDAREA „OMICS” ÎNTR-O ERA AMBIGUOSĂ DE REZISTENȚĂ ANTIMICROBIANĂ ÎNALTĂ
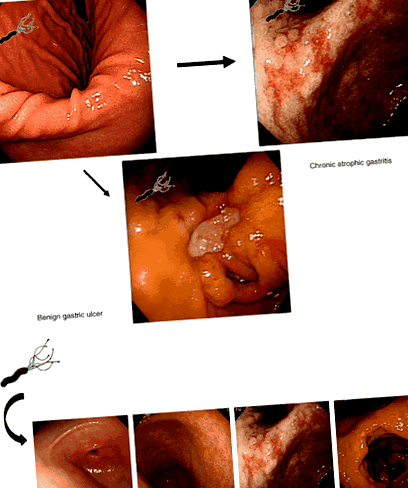
Progresia de Helicobacter pylori (H. pylori)‐Leziuni gastrice asociate (a) care duc la dezvoltarea bolii ulcerului peptic benign și a gastritei atrofice cronice. (b) H. pylori‐Gastrită asimptomatică/acută asociată; gastrită atrofică cronică; metaplazie intestinală; si cancer gastric.
Mai mult, multe probleme nerezolvate există și în terapia de eradicare. Deși cel mai eficient tratament de eradicare este combinația unui inhibitor al pompei de protoni cu două sau trei tipuri de antibiotice, aproximativ 20% -30% dintre pacienți nu reușesc să reușească eradicarea, pentru care rezistența la antibiotice este un factor major 9, 10 Acesta este motivul pentru care terapiile non-antibiotice, inclusiv fitoceutice, probiotice și antioxidanți, au fost cercetate din ce în ce mai mult ca potențiale alternative pentru H. pylori. 11, 12 Munca este, prin urmare, necesară fie pentru a dezvolta abordări alternative non-microbiene, fie pentru a găsi un biomarker optim care să prevadă punctul de neîntoarcere. O strategie de screening de mare randament care încorporează abordarea „omics” poate fi instrumentul potrivit pentru a rezolva problema în această perioadă post-genomică (Figura 1b).
LECȚII DIN ANALIZA MICROARRAIEI ȘI PROTEOMICĂ ÎN H. PYLORI INFECŢIE
Au fost încercate mai multe tehnologii de analiză de mare capacitate pentru a îndeplini o abordare nutrigenomică pentru întinerirea gastritei atrofice. Una dintre ele, tehnologia microarray cDNA, este un instrument puternic pentru analiza profilului de expresie a mii de gene la nivel global. 13 Unele dintre aceste date oferă o privire asupra marii diversități genetice a H. pylori 14 și diferența genetică diferențială între tulpini, precum și asocierea dintre expresia grupului de gene și rezultatul clinic. 15 Majoritatea acestor studii raportează o modificare a expresiei genelor legată de funcțiile de transcripție, semnale de transducție, reglarea și diferențierea ciclului celular, echilibrul dintre proliferare și apoptoză, expresia proteinelor de membrană și matricile de răspuns inflamator după H. pylori infecţie. Hoffman și colab. 16 au explorat profilurile de expresie genică ale biopsiilor gastrice de la 69 de pacienți caucazieni francezi, dintre care 42 au fost infectați H. pylori, furnizarea de date pentru identificarea mecanismelor moleculare care conduc H. pylori‐Carcinogeneza asociată înainte de dovezile morfologice ale acestor modificări.
microarray de ADNc pentru genomii implicați în progresia (a) leziunilor premaligne și în (b) Helicobacter pylori‐Carcinogeneza asociată.
În al doilea rând, pentru a identifica proteomii responsabili în funcție de starea bolii H. pylori‐Bolie gastrică asociată, am efectuat electroforeză bidimensională pe gel urmată de analiză proteomică la patru pacienți cu gastrită ușoară asimptomatică (dispepsie funcțională), trei pacienți cu gastrită cronică superficială simptomatică care au prezentat un grad mai mult decât moderat de patologie, cinci pacienți cu CAG și doi pacienți cu GC avansat, respectiv (Figura 3). S-au făcut analize diferențiale pentru a identifica fie pete proteome crescute, fie scăzute între pacienți utilizând software-ul de analiză a imaginii, după care fiecare punct identificat a fost supus digestiei cu gel de tripsină, analiză de masă și în final o căutare dedusă peptidelor. O schimbare cheie semnificativă a fost scăderea proteinelor de șoc termic (HSP) 70.
Proteomica pentru identificarea biomarkerilor responsabili de progresia H. pylori‐Boli gastrice asociate. Rezultatele analizei sunt prezentate reprezentând expresia semnificativ diferită dintre cancerul gastric și gastrita atrofică cronică și cancerul gastric; scăderea HSP70, izocitrat dehidrogenază + precursor alfa, glucoză - 6 - fosfat 1 - dehidrogenază, ubiquitină - enzimă conjugatoare E2, proteină KIAA1684, proteină de interacțiune SNAP25, keratină 1, proteină deget de zinc 12, microtubul - factor de reticulare actină 1, subunitate 3, Proteina de legare a Tat, acil - coenzima A dehidrogenază C - 2 până la C - 3 precursor cu lanț scurt, piruvat dehidrogenază E1 - beta prezintă precursor, desmin mutant și așa mai departe.
În cele din urmă, pe baza rezultatelor din microarray cDNA și proteomică, a fost aplicată o abordare nutrigenomică la pacienții cu H. pylori‐CAG asociat prin intervenția ginsengului roșu coreean (Figura 4). Nutrigenetica a fost utilizată de zeci de ani în anumite boli monogene rare, cum ar fi fenilcetonuria, iar tehnica are potențialul de a oferi o bază pentru recomandări dietetice personalizate bazate pe machiajul genetic al unui individ, în timp ce nutrigenomica, definită ca aplicarea genomică, transcriptomică, proteomică și studiile metabolomice la răspunsurile umane la nutriție, încearcă să ofere o înțelegere genetică a modului în care substanțele chimice dietetice obișnuite afectează echilibrul dintre sănătate și boală, modificând expresia sau structura, sau ambele, ale machiajului genetic al unui individ. 18-20 Prin urmare, se așteaptă ca nutrigenomica să crească cunoștințele fundamentale despre interacțiunile dintre procesele bolii și dietele (inclusiv fitoceutice). În secțiunea următoare, arătăm intervenția nutrigenomicii pentru a documenta eficacitatea ginsengului roșu coreean în H. pylori‐Gastrita cronică asociată.
Abordarea non - microbiană pentru abordarea progresului Helicobacter pylori H. pylori‐Boli gastrice asociate de la (stânga) asimptomatică, acută sau cronică, gastrită atrofică cronică, la metaplazie intestinală și cancer gastric. În articolul actual, a fost introdusă intervenția nutrogenomică a ginsengului roșu coreean.
NUTRIGENOMIE PENTRU REÎNTÂNIREA GASTRITEI ATROFICE
O abordare nutrigenomică a homeostaziei.
Dintre potențialii biomarkeri descoperiți pentru a prezice un răspuns favorabil cu ginsengul roșu coreean, HSP, care este omniprezent în expresie și apare în toate organismele de la bacterii și drojdie la oameni, 24 a fost clasificat în patru mari familii în funcție de activitățile lor biologice și de greutățile moleculare aparente; HSP90, HSP70, HSP60, HSP27 și HSP10. În timp ce HSP60, HPS70 și HSP90 sunt exprimate în mod constitutiv, HSP70 și HSP10 sunt induse de diferite condiții. HSP joacă roluri fiziologice importante în condiții normale și în situații patologice care implică atât stres sistemic, cât și celular. Mai mult, majoritatea HSP-urilor au efecte citoprotectoare puternice, sunt implicate în multe căi de reglare și păstrează proteine celulare importante. 21, 25, 26 HSP funcționează în principal ca chaperone moleculare care participă la plierea și asamblarea proteinelor născute și care se desfășoară și facilitează transportul proteinelor către compartimentele subcelulare.
Dovezi de susținere care validează rezultatele nutritive
Mai multe studii 17, 29 au demonstrat că ginsengul exercită efecte antioxidante, anti-bacteriene și antiinflamatorii. Se știe că ginsenozida Rb1 inhibă expresia citokinelor pro-inflamatorii indusă de lipopolizaharidă, factorul de necroză a tumorii - α și s-a raportat că polizaharida acidă din ginseng inhibă aderența H. pylori la celulele epiteliale gastrice umane. Pe lângă aceste acțiuni antimicrobiene, ginsengul are o acțiune inhibitorie distinctă asupra creșterii celulare în diferite celule de carcinom. 30 Atunci, ce zici de efectul ginsengului roșu coreean asupra H. pylori‐Celule mucoase gastrice infectate? Autorii 12, 31 au documentat că ginsengul roșu coreean poate reduce H. pylori- Citotoxicitatea indusă și atenuarea mutației ADN induse de stresul oxidativ, pe lângă scăderea H. pylori‐Expresia interleukinei stimulate - 8, sugerând că ginsengul roșu coreean poate fi utilizat ca fitonutrient medicinal împotriva H. pylori infecţie. Apoi am întrebat dacă ar putea fi posibilă întinerirea gastritei atrofice la non-atrofie cu ginseng roșu coreean, 5 la care răspunsul este „posibil da”, dar nu în toate cazurile.
CONCLUZIE
Identificarea mecanismelor moleculare prin care inflamația cronică crește riscul de cancer sau medicamentele sau nutrienții vizați pentru a întârzia carcinogeneza indusă de inflamație ar putea fi o bază necesară pentru dezvoltarea unei noi strategii de prevenire a cancerului în multe locuri. În această revizuire, am discutat despre posibilitățile de prevenire a cancerului prin controlul procesului inflamator în H. pylori infecția abordată prin bază nutrigenomică, printre care ginsengul roșu coreean a fost un bun exemplu de plantă naturală care are proprietăți omniprezente conducătoare la oprirea carcinogenezei inflamatorii, întinerirea CAG, inversarea metaplaziei intestinale și menținerea homeostaziei gastrice.
CONFIRMARE
Cercetarea a fost realizată în cadrul unei subvenții din partea Ministerului Educației, Științei și Tehnologiei (2010‐0002052), Republica Coreea și susținută de o subvenție din 2010 a Societății Coreene din Ginseng, finanțată de Coreea Ginseng Cooperare.