Divizia de Științe Biomedice de Bază, Școala de Medicină Sanford, Universitatea din Dakota de Sud, Vermillion, Dakota de Sud
Adresa pentru cereri de retipărire și alte corespondențe: Barbara E. Goodman, Sanford School of Medicine, Univ. din Dakota de Sud, 414 E. Clark St., Vermillion, SD 57069 (e-mail: [e-mail protejat]).
Abstract
profesorii cursurilor universitare de fiziologie pot atribui în mod obișnuit studenților următoarea întrebare: „Să fiți capabili să descrieți în detaliu pașii din întregul tract gastrointestinal (GI) al mamiferelor pentru digestia și absorbția UNUI din cele trei grupe de nutrienți”. Cu alte cuvinte, spuneți cum sunt defalcați carbohidrații, proteinele sau grăsimile (în ce organe și prin ce enzime) și apoi descrieți modul în care sunt absorbiți produsele finale de descompunere (cum intră în celulele epiteliale intestinale, traversează celula și cum pleacă celulă, inclusiv dacă intră în fluxul sanguin sau în sistemul limfatic). Informațiile prezentate în clasă au în general aproximativ 10 pași de bază pentru digestia și absorbția completă a fiecărui grup major de nutrienți. Diagramele găsite în majoritatea manualelor universitare de fiziologie urmăresc să explice în mod clar detaliile acestor pași studenților.
Profesorii în biochimie medicală pentru studenții din anul I de medicină pot susține prelegeri despre „Digestia și absorbția carbohidraților/proteinelor/grăsimilor”. În timp ce manualele universitare de fiziologie tind să treacă peste detaliile digestiei diferiților nutrienți (care sunt enzimele și cum funcționează acestea), manualele de biochimie medicală tind să treacă peste detaliile transportoarelor necesare pentru absorbția produselor de defalcare nutrienții și soarta nutrienților din organism. În plus, de la sfârșitul anilor 1970, multe dintre detaliile despre digestie și transport au fost elucidate. Au fost descoperiți noi transportatori (cum ar fi transportatorii de H + -oligopeptide și transportatorii de acizi grași). Acest articol de revizuire urmărește să evidențieze cunoștințele învățate în studiul digestiei, absorbției și transportului carbohidraților, proteinelor și lipidelor dietetice. Descrierile și diagramele se adresează unui public de profesori de fiziologie care doresc să înțeleagă detaliile biochimiei digestiei și fiziologiei transportului epitelial al componentelor nutritive. În plus, sunt descrise mai multe implicații clinice ale proceselor defecte pentru a oferi exemple relevante studenților din cariera de sănătate.
Digestia și absorbția carbohidraților
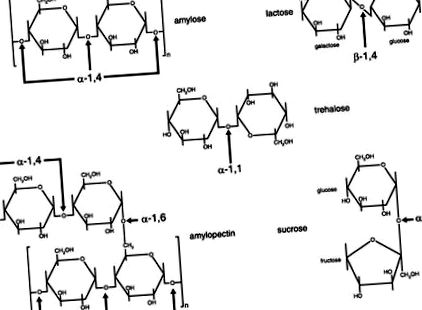
FIG. 1.Diagramele structurilor legăturilor dintre porțiunile de carbohidrați din dizaharide dietetice și polizaharide. Zaharurile sunt legate prin legături glicozidice între carbonul unui zahăr și o grupare hidroxil pe un alt zahăr. Legătura poate fi fie α, fie β, în funcție de poziția sa deasupra sau sub planul zahărului. [Modificat din Ref. 6.]
În interiorul intestinului subțire, sucul pancreatic pătrunde în lumen prin sfincterul hepatopancreatic (sfincterul lui Oddi), iar concentrația sa ridicată de bicarbonat începe să neutralizeze acidul gastric. Concomitent, α-amilaza pancreatică ajunge la lumen și continuă să descompună în mod activ carbohidrații complecși în maltoză, maltotrioză (izomaltoză), trizaharide, oligozaharide mai mari și dextrine α-limită (oligozaharide cu puncte ramificate) (9). Deoarece di-, tri- și oligozaharidele rezultă din hidroliza amidonului de către α-amilază, este necesară o digestie suplimentară înainte de absorbția produselor de amidon din monozaharide. Aceste produse de hidroliză a amidonului trebuie descompuse în continuare de dizaharidazele care se găsesc ca enzime care se întind pe membrană în membranele plasmatice ale marginilor periei celulelor epiteliale intestinale (enterocite) (4). Tabelul 1 prezintă un rezumat al carbohidraților majori găsiți în alimente cu sursele lor tipice, legăturile chimice, enzimele de membrană de la marginea pensulei necesare și produsele finale monozaharidice.
Tabelul 1. Surse de carbohidrați, tipuri de legături glicozidice, enzime de membrană și produse monozaharidice
[Modificat din Ref. 6.]
O altă enzimă membranară cu perie este trehalaza, care hidrolizează legătura glicozidică din trehaloză, o dizaharidă mică, neobișnuită în dieta americană (9). Trehaloza se găsește în insecte, alge, ciuperci tinere și alte ciuperci și poate provoca suferință gastro-intestinală dacă este consumată de o persoană fără cantități adecvate de trehalază (1). Trehaloza nedigerată care ajunge în colon determină, de asemenea, un gradient osmotic care duce la scaune libere și diaree, urmată de digestia trehalozei de către microflora din colon, producând gaze (în special hidrogen și metan, care apar în aerul expirat) (1). Trehalaza este mai scurtă decât celelalte dizaharidaze și are un singur sit catalitic pentru hidrolizarea legăturii α-1,1 dintre moleculele de glucoză din trehaloză. Este încă neclar cât de variabilă poate fi activitatea trehalazei duodenale la populația umană; cu toate acestea, studii efectuate cu eschimoși în Groenlanda și cu persoane din Finlanda au identificat atât indivizi autoproclamați cu intoleranță la ciuperci, cât și indivizi cu deficit de trehalază (1).
A-amilaza pancreatică acționează mai ales în duoden la scurt timp după intrarea sa prin sfincterul hepatopancreatic și generează maltoză, maltotrioză și dextrine limită α din carbohidrați complecși (6). Sucrase-izomaltaza și β-glicozidaza au o distribuție și o activitate ridicate în jejunul proximal, în timp ce glucoamilaza are cea mai mare activitate în ileonul proximal (9). Astfel, distribuția spațială a acestor dizaharidaze (activitate mică în duoden și ileon distal și niciuna în intestinul gros) maximizează activitatea acestora pentru a se coordona cu segmentele intestinului subțire unde predomină transportorii de glucoză (4). Aceste dizaharide contribuie astfel la fenomenul cunoscut sub numele de digestie membranară și oferă monozaharide pentru absorbție în celulele epiteliale.
Odată ce monozaharidele rezultă din digestia glucidelor de către α-amilază și enzimele membranei de la marginea pensulei, monozaharidele sunt preluate de enterocite prin intermediul proteinelor de transport specifice care facilitează transportul izomerilor d (dar nu și ai izomerilor l) ai hexozelor (4). d-Glucoza și d-galactoza sunt preluate de simporterul secundar de transport activ cuplat cu Na + cunoscut sub numele de transportor de Na + -glucoză 1 (SGLT1). SGLT1 este un transportor de Na + -glucoză cu afinitate ridicată, cu 12 domenii α-elicoidale care se întind pe transmembrană și 662 reziduuri de aminoacizi cu o masă de ~ 74 kDa (15). Este Km pentru transportul zahărului este o funcție a concentrației de Na +, iar stoichiometria sa este de 2 Na + pentru fiecare moleculă de d-glucoză (15). În absența Na +, d-glucoza se leagă de SGLT1 cu o afinitate mult mai mică (glucoza Km >> 10 mM), dar în prezența Na +, o modificare conformațională permite zahărului să se lege cu afinitate mare (glucoză) KConcentrația m + este scăzută (m10 mM), Na + se disociază de locul său de legare, determinând scăderea afinității transportoare pentru d-glucoză, iar zahărul este eliberat în citoplasma celulei. Transportorul trebuie să-și finalizeze ciclul printr-o a treia tranziție mult mai lentă pentru a reorienta siturile de legare către suprafața extracelulară (15).
Astfel, SGLT1 profită de gradientul de Na + (adică, concentrație scăzută de Na + intracelular) care este creat de Na + basolaterale, K + -ATPaze pentru a aduce hexoze în enterocite. Deoarece SGLT1 deplasează 2 Na + cu fiecare d-glucoză, este capabil să genereze un gradient de concentrație de glucoză pe membrana luminală de 10.000 de ori (3). Ulterior, d-glucoza poate lăsa celula pe partea basolaterală a celulei prin intermediul unor transportoare de difuzie facilitate [transportoare de glucoză (GLUT2s)] de la o concentrație mare în interiorul celulei la o concentrație scăzută în afara celulei (4). GLUT-urile sunt proteine integrale de transport membranar pliate în 12 helice α care se întind pe transmembrană, care formează un canal apos central pentru mișcarea substratului (d-glucoză, d-galactoză sau fructoză) pe stratul bistrat lipidic. Dintre cele cinci GLUT originale, numai GLUT2 și GLUT5 sunt capabile să transporte fructoză, iar GLUT5 are o capacitate foarte limitată de transport a d-glucozei (12). GLUT2-urile se disting prin faptul că sunt un sistem de transport cu afinitate scăzută și cu o rotație mare, cu un Km în ovocite de 11 mM. GLUT2-urile se găsesc în membranele bazolaterale intestinale și renale (predominant), în ficat și în celulele β ale pancreasului și mediază atât absorbția, cât și efluxul de glucoză, galactoză sau fructoză (12).
Cu toate acestea, fructoza nu este transportată de SGLT1, ci este preluată mai degrabă de pe marginea pensulei a enterocitului de către transportorul specific difuzat facilitat GLUT5. GLUT5s prezintă cea mai slabă omologie față de ceilalți membri ai familiei GLUT dintre toate GLUT și servesc în primul rând ca transportori de fructoză cu un Km de 6 mM (12). Acestea se găsesc în membranele țesuturilor care metabolizează fructoza, inclusiv în membranele cu perii ale celulelor intestinale și membranele spermatozoizilor. Acestea sunt probabil principala cale de absorbție a fructozei în intestinul subțire. Conversia intracelulară a fructozei în glucoză și acid lactic își menține concentrația intracelulară scăzută, ajutând absorbția sa continuă prin difuzarea facilitată din lumen. Deoarece fluxul sanguin adiacent celulelor epiteliale intestinale îndepărtează continuu zaharurile care traversează enterocite întregi, glucoza, galactoza și orice fructoză intactă rămasă iese ușor din celule în gradienții lor de concentrație prin difuzarea facilitată a GLUT2s fără utilizarea energiei celulare. Figura 2 prezintă o diagramă rezumativă a etapelor implicate în digestia și absorbția carbohidraților.
FIG. 2.Rezumatul etapelor de bază implicate în digestia și absorbția glucidelor cu enzime și transportori importanți. Pașii sunt explicați mai detaliat în text. SGLT1, transportor Na + -glucoză 1; GLUT, transportor de glucoză. [Modificat din Ref. 13.]
Exemplu clinic.
Malabsorbția glucozei-galactozei este o boală genetică rară în care pacientul are absorbție intestinală deficitară a d-glucozei și a d-galactozei (15). Se prezintă ca debut neonatal al diareei severe, apoase, care poate duce la moarte, cu excepția cazului în care echilibrul apei și al electroliților se restabilește rapid. Eliminarea completă a glucozei, galactozei și lactozei din dietă oprește diareea în decurs de 1 oră. Studiile moleculare au arătat că mutații multiple în SGLT1 duc la malabsorbție glucoză-galactoză în intestinul subțire; cu toate acestea, acei pacienți cu capacități scăzute de absorbție a glucozei nu au glicozurie (glucoză în urină) deoarece celulele epiteliale ale tubului proximal renal (spre deosebire de enterocitele cu numai SGLT1 la persoanele sănătoase) folosesc atât SGLT1, cât și SGLT2 pentru absorbția glucozei în filtrat (4) și SGLT2 nu este mutat simultan.
Digestia și absorbția proteinelor
Sarcina zilnică totală de proteine este de –70–100 g de proteine dietetice și 35–200 g de proteine endogene, inclusiv enzimele digestive și celulele moarte (6). O varietate de enzime proteolitice este necesară pentru a descompune proteinele dietetice în aminoacizi și peptide mici, deoarece fiecare enzimă are specificitate pentru diferite tipuri de legături peptidice. Endopeptidazele atacă anumite legături interne și duc la polipeptide mari, în timp ce exopeptidazele scindează câte un aminoacid, fie din carboxi, fie din capătul amino al polipeptidei sau proteinei.
Proteinele sau polipeptidele consumate încep să fie descompuse în stomac sub acțiunea proteazei pepsină (4). Pepsina este secretată de celulele principale din mucoasa gastrică sub numele de pepsinogen, o formă inactivă mai mare a enzimei, cunoscută și sub numele de zimogen. Acidul gastric (HCl, secretat de celulele parietale) modifică conformația pepsinogenului astfel încât să se poată despică și să devină pepsină activă în stomac. De asemenea, acidul gastric denaturează proteinele, care le desfășoară parțial, astfel încât proteazele să aibă un acces mai bun la legăturile lor peptidice. Pepsina (o endopeptidază) din stomac începe să hidrolizeze proteinele în diferite puncte de clivaj la polipeptide mai mici (6). Pepsina are o specificitate mai mare pentru scindarea legăturilor peptidice în care gruparea carboxil este asigurată de aminoacizi aromatici precum tirozina, fenilalanina, triptofanul și leucina (6). Deși pepsina poate digera parțial 10-15% proteine dietetice în stomac, hidroliza pepsinei nu este necesară pentru supraviețuire (pacienții trăiesc cu gastrectomie completă) (4).
Pe măsură ce chimul (alimente parțial digerate) pătrunde în intestinul subțire, enzimele proteazei pancreatice sunt excretate prin sfincterul hepatopancreatic împreună cu bicarbonatul pancreatic. Bicarbonatul începe să neutralizeze acidul din stomac și crește pH-ul la un nivel mai optim pentru activitatea proteazelor pancreatice. Proteazele pancreatice sunt toate secretate sub formă de zimogeni, pentru a nu deveni activi în interiorul pancreasului și astfel provoca pancreatită. Tripsinogenul zimogen este scindat pentru a forma tripsina de către enteropeptidază (cunoscută anterior ca enterokinază), o enzimă jejunală de la marginea periei care poate fi eliberată prin acțiunea sărurilor biliare (9). Tripsina catalizează apoi scindarea celorlalți zimogeni la formele lor active. Proteazele pancreatice (tripsina, chimotripsina, elastaza și carboxipeptidaze) scindează polipeptidele în oligopeptide și aminoacizi (Tabelul 2). Tripsina, chimotripsina și elastaza sunt serin proteaze și acționează ca endopeptidaze (9). Tripsina este cea mai specifică și scindează legăturile peptidice lângă lizină sau arginină. Chimotripsina este mai puțin specifică și clivează legături peptidice adiacente aminoacizilor hidrofobi. Elastaza clivează elastina și legăturile peptidice adiacente alaninei, glicinei și serinei.
Tabelul 2. Caracteristicile peptidazelor gastrice, instestinale și pancreatice