Abstract
fundal
În ciuda dovezilor care leagă obezitatea de funcția imunitară afectată, se știe puțin despre mecanismele specifice. Datorită dovezilor emergente că răspunsurile imune sunt reglate epigenetic, am emis ipoteza că modificările metilării ADN sunt implicate în disfuncția imună indusă de obezitate și ne-am propus să identificăm aceste modificări.
Metodă
Am efectuat o analiză de metilare a genomului pe șapte cazuri obeze și șapte controale slabe cu vârsta cuprinsă între 14 și 18 ani de la capetele extreme ale distribuției obezității și am efectuat o validare suplimentară a șase situri CpG din șase gene în 46 de cazuri obeze și 46 martori slabi cu vârsta cuprinsă între 14 și 30 ani.
Rezultate
În comparație cu controalele slabe, am observat un situs CpG în gena UBASH3A care prezintă niveluri mai mari de metilare și un situs CpG în gena TRIM3 care prezintă niveluri mai scăzute de metilare în cazurile obeze în ambele etape ale genomului (P = 5 × 10 -6 și P = 2 × 10 -5 pentru gena UBASH3A și respectiv TRIM3) și etapa de validareP = 0,008 și P = 0,001 pentru gena UBASH3A și respectiv TRIM3).
Concluzii
Rezultatele noastre oferă dovezi că obezitatea este asociată cu modificări ale metilării ADN-ului leucocitelor din sânge. Sunt justificate studii suplimentare pentru a determina direcția cauzală a acestei relații, precum și dacă astfel de modificări de metilare pot duce la disfuncții imune.
fundal
Obezitatea este epidemia timpului nostru, cu rate crescând brusc și constant [1, 2]. Consecințele adverse majore ale obezității, inclusiv diabetul de tip 2, ateroscleroza și hipertensiunea arterială esențială, atunci când sunt adăugate, reprezintă un număr mare de decese legate de boli [3, 4]. Dacă la acest număr se adaugă cazurile de cancer legate de obezitate, mortalitatea legată de obezitate o depășește cu mult pe cea a altor boli frecvente [5]. Acesta din urmă indică necesitatea urgentă de a dezvolta noi modalități terapeutice eficiente pentru această afecțiune.
Numitorul comun în patogeneza comorbidităților obezității este prezența unui proces inflamator activ, de grad scăzut [6]. În ciuda dovezilor care leagă obezitatea de modificările răspunsului inflamator, se știe puțin despre efectele specifice ale obezității asupra sistemului imunitar. Recent, a existat o apreciere mai mare a rolului epigeneticii, modificări ereditare meiotic și mitotic în expresia genelor care nu sunt codificate în secvența ADN în sine, în răspunsurile imune și inflamatorii [7-9]. Prin urmare, presupunem că modificările metilării ADN joacă un rol în disfuncția imună indusă de obezitate. Scopul acestui studiu a fost de a caracteriza profilul de metilare a ADN-ului în leucocitele din sângele periferic la subiecții obezi versus slabi, utilizând o abordare genomică. Identificarea modificărilor de metilare în gene specifice va oferi obiective importante pentru studierea ulterioară a mecanismelor efectului obezității asupra sistemului imunitar și a potențialului de a dezvolta noi terapii pentru tratarea comorbidităților obezității multiple.
Metode
Subiecte
Analiza de metilare a genomului larg a fost efectuată în șapte martori obezi și șapte în funcție de vârstă. Acești 14 subiecți au fost identificați din participanții (n = 534) la studiul privind stilul de viață, adipozitatea și sănătatea cardiovasculară la tineri (LACHY) utilizând următoarele criterii de incluziune: (1) strămoși afro-americani (AA); (2) mic; (3) având ADN leucocitar disponibil; (4) cazuri obeze cu un indice de masă corporală (IMC) ≥ 99 percentilă pentru vârstă și sex și controale slabe cu IMC ≥ 10 percentil pentru vârstă și sex. Studiul LACHY a constat dintr-un număr aproximativ egal de adolescenți AA și europeni americani (EA) cu vârsta cuprinsă între 14 și 18 ani de ambele sexe recrutați din liceele din zona Augusta, Georgia [10].
Pentru toate cele patru cohorte autoidentificarea prin auto-raportări ale fiecărui subiect sau de către un părinte dacă subiectul avea vârsta sub 18 ani a fost utilizată pentru a clasifica etnia conform criteriilor descrise anterior [14]. Subiecții din toate cele patru studii au fost în mod evident sănătoși, lipsiți de orice boală acută sau cronică pe baza rapoartelor părintești și nu au luat medicamente antihipertensive, hipolipemiante, anti-diabetice și antiinflamatoare [10-13]. Comitetul de revizuire instituțională de la Colegiul Medical din Georgia a aprobat studiile. Consimțământul informat a fost obținut de la toți subiecții și de către părinți dacă subiecții aveau vârsta mai mică de 18 ani.
Măsurători
Pentru toate cele patru cohorte, înălțimea și greutatea au fost măsurate prin metode standard folosind un stadiometru montat pe perete și, respectiv, o cântare. IMC a fost calculat ca greutate/înălțime 2. BPA sistolică (SBP) și BP diastolică (DBP) au fost măsurate cu monitoare Dinamap, folosind o manșetă BP de dimensiuni adecvate, plasată pe brațul drept al subiectului. Măsurătorile TA au fost luate la 11, 13 și 15 minute, într-o perioadă de relaxare în decubit de 15 minute. Media ultimelor două citiri a fost utilizată pentru a reprezenta valorile SBP și DBP [10-13].
Au fost recoltate probe de sânge periferic în jeun în cohorta LACHY și probe de sânge periferic care nu postesc în celelalte trei cohorte. Învelișul tampon și probele de plasmă au fost separate și depozitate la -80 ° C. ADN-ul a fost extras din stratul tampon. În cohorta LACHY, nivelurile de glucoză la jeun au fost măsurate utilizând sistemul Ektachem DT II (Johnson și Johnson Clinical Diagnostics, Rochester, NY, SUA) și insulina la jeun a fost testată în duplicat prin radioimunotest specific (Linco Research, Inc., St Charles, MO, SUA) [10]. QUICKI (indicele cantitativ de verificare a sensibilității la insulină) a fost calculat pentru a indexa sensibilitatea la insulină utilizând următoarea formulă: 1/[log (insulină de post, μU/ml) + log (glucoză de post, mg/dl)]. Din eșantionul de screening care a inclus cele șapte cazuri obeze și șapte controale slabe selectate din cohorta LACHY, nivelurile de glucoză și insulină la jeun nu au fost disponibile pentru un caz și un control.
Cip de metilare cu genom larg
A fost utilizat HumanMethylation27 BeadChip de la Illumina (Illumina, San Diego, CA, SUA). Acest cip poate măsura cantitativ 27.000 de site-uri CpG, acoperind peste 14.000 de gene bine adnotate la o rezoluție single-CpG. Fiecare cip poate găzdui 12 probe. După tratamentul cu bisulfit, 200 ng din ADN-ul convertit a fost amplificat în întregul genom (WGA) și fragmentat enzimatic. Probele WGA-ADN transformate în bisulfit au fost purificate și aplicate pe BeadChips. Procesarea imaginilor și extragerea datelor de intensitate au fost efectuate conform instrucțiunilor Illumina http://www.illumina.com/products/infinium_humanmethylation27_beadchip_kits.ilmn. Fiecare punct de date de metilare este reprezentat de semnale fluorescente de la alelele metilate și nemetilate. Valorile beta de metilare ADN sunt variabile continue între 0 (complet nemetilat) și 1 (complet metilat), reprezentând raportul dintre intensitatea tipului de margele metilată și intensitatea locusului combinat. Procesarea inițială a matricei și controlul calității au fost efectuate cu software-ul BeadStudio. Datele despre microarray discutate în această lucrare au fost depozitate în Omnibusul de expresie genică al NCBI și sunt accesibile prin numărul de acces GSE25301 din seria GEO http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE25301.
Pirosequencing
Nivelurile de metilare ale celor șase situsuri CpG selectate din cele șase gene din cohorta de replicare au fost determinate prin tehnologia pirozecvenței, o metodă rapidă și robustă pentru analiza cantitativă a metilării. După tratamentul cu bisulfit, 10 ng de ADN convertit au fost utilizate într-o reacție PCR pentru a amplifica regiunea țintă. Unul dintre primerii PCR a fost marcat cu biotină. Produsele PCR biotinilate monocatenare au fost preparate pentru secvențiere utilizând instrumentul de preparare sub vid Pyrosequencing conform instrucțiunilor producătorului. Produsele PCR (fiecare 10 μl) au fost secvențiate prin Pyrosequencing PSQ96 HS System (Pyrosequencing-Qiagen) urmând instrucțiunile producătorului. Starea de metilare a fiecărui locus a fost analizată individual ca un SNP T/C utilizând software-ul QCpG (Biotage, Kungsgatan, Suedia). Primerii PCR și primerii de secvențiere pentru aceste șase gene sunt enumerați în fișierul suplimentar 1. Toate probele au fost analizate în aceeași perioadă și într-o secvență aleatorie.
analize statistice
Pentru analiza metilării pe scară largă a genomului, pachetul Limma [15] a fost utilizat pentru a analiza fiecare situs CpG pentru metilarea diferențială între subiecții obezi și slabi. Siturile CpG de pe cromozomii × și Y au fost excluse din analiză. Fiecărui site CpG i s-a atribuit un raw P-valoare bazată pe o statistică t moderată. Pentru a corecta testarea multiplă, setul de materii prime P-valorile au fost convertite în rate de descoperire false (FDR) conform lui Benjamini și Hochberg [16]. Pentru cele șase site-uri CpG din cohorta de replicare, un Student t-testul a fost utilizat pentru a investiga dacă nivelurile lor de metilare diferă între grupul obez și cel slab. Regresia liniară a fost folosită în continuare pentru a ajusta efectul potențial al vârstei asupra nivelurilor de metilare. Am combinat pașii genomului larg și pașii de replicare pentru aceste șase situri CpG folosind metoda de analiză bazată pe scor z ponderată, implementată în pachetul METAL [17]. Înainte de analiză, nivelurile de metilare ale situsurilor CpG din cohorta de replicare au fost transformate în log sau transformate în rădăcină pătrată pentru a obține o aproximare mai bună a distribuției normale. Analizele preliminare, testele t și analizele de regresie au fost făcute folosind STATA 8 (StataCorp, College Station, TX, SUA).
Analiza Ontologiei genetice a fost efectuată cu instrumentul FatiGO [18]. FatiGO ia două liste de gene și le transformă în două liste de termeni GO. Apoi, testul exact al lui Fisher pentru tabelele de contingență 2 × 2 este utilizat pentru a verifica supra-reprezentarea semnificativă a termenilor GO într-unul dintre seturi față de celălalt. Corecție de testare multiplă (indexată prin ajustat P-valori) pentru a ține cont de ipoteza multiplă testată (una pentru fiecare termen GO) se aplică pentru a reduce falsurile pozitive. Deoarece cel puțin două situsuri CpG au fost incluse pentru majoritatea genelor din acest cip larg de genom, am selectat siturile CpG cu cea mai mică valoare p pentru a reprezenta această genă.
Rezultate
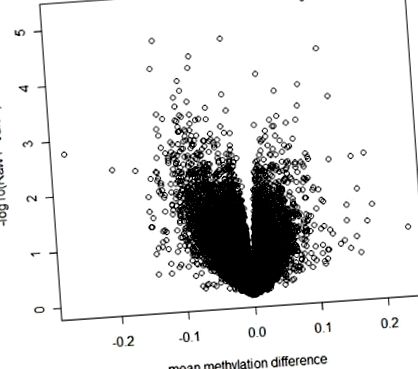
Complotul vulcanului arată brut P- valori comparativ cu diferența medie de metilare între cazurile obeze și martorii slabi.
Deși testul de pirosecvențiere a fost conceput pentru a viza un situs CpG specific pentru fiecare genă, unele dintre teste au acoperit mai multe situri CpG înconjurătoare. Rezultatele acestor situri CpG sunt, de asemenea, enumerate în Tabelul 4. Corelația dintre probe între multiplele situri CpG măsurate într-o genă este listată în fișierul suplimentar 3.
Analiza Ontologiei genetice a fost efectuată pentru a testa dacă unele tendințe funcționale comune în funcțiile moleculare și procesele biologice au fost asociate cu genele care prezintă diferențe între cazurile obeze și controalele slabe în cipul larg al genomului. Am inclus acele gene cu o materie primă P ≤ 0,01 la prima listă (n = 298) și a inclus toate celelalte gene în a doua listă. Așa cum era de așteptat dintr-un studiu pilot pe 14 subiecți, nu am observat nicio categorie GO supraviețuind testelor multiple. Tabelul 5 listează categoriile GO cu raw P-valoare mai mică de 0,05. Interesant, am observat procese funcționale îmbogățite care sunt potențial relevante pentru răspunsul inflamator cu răspuns imun (GO: 0006955), activarea celulelor (GO: 0001775), producția de citokine (GO: 0001816), răspuns la stimulul biotic (GO: 0009607) și antigen obligatoriu (GO: 0003823) printre categoriile GO de top. Rezultatele susțin că obezitatea ar putea duce la modificări ale metilării genelor implicate în căile inflamatorii.
Discuţie
În acest studiu ne-am propus să identificăm modificările de metilare legate de obezitate în leucocitele din sângele periferic utilizând o abordare largă a genomului la tineri și adulți tineri care nu prezintă comorbidități ale obezității. Principalele constatări ale acestui studiu sunt nivelurile crescute de metilare la un situs CpG din UBASH3A genă și scăderea nivelului de metilare la un situs CpG în TRIM3 genă la subiecții obezi comparativ cu martorii slabi.
Există mai multe puncte forte ale acestui studiu. În primul rând, am selectat cazuri obeze și controale cu fenotipuri extreme, care maximizează puterea de a face descoperiri. În al doilea rând, ne-am concentrat asupra tinerilor și adulților tineri cu avantajul distinct că rezultatele nu sunt confundate de comorbiditățile obezității sau de utilizarea medicamentelor, ambele fiind foarte frecvente la subiecții adulți cu obezitate. În al treilea rând, a fost utilizată o abordare largă a genomului fără ipoteze. Această abordare înlocuiește limitările impuse de studiile candidate de metilare a genelor și permite căutarea întregului genom într-o manieră imparțială.
Concluzie
În acest studiu, am identificat mai multe modificări reproductibile în metilarea ADN a leucocitelor din sângele periferic între cazurile obeze și controalele slabe. Acest studiu oferă dovezi că obezitatea este asociată cu modificări de metilare în ADN-ul leucocitelor din sânge. Sunt justificate studii suplimentare pentru a determina direcția cauzală a acestei relații, precum și dacă astfel de modificări de metilare pot duce la disfuncții imune. Astfel de studii vor avea capacitatea de a identifica noi perspective asupra etiologiei bolilor și de a oferi noi obiective pentru prevenirea bolilor legate de obezitate, cum ar fi bolile cardiovasculare și diabetul de tip 2.