Lipaza pancreatică eliberată în fluidele tisulare înconjurătoare în timpul pancreatitei acute poate crește acizii grași liberi care pot saponifica calciu în sânge pe măsură ce acesta curge prin pancreas, rezultând o scădere semnificativă a calciului seric.
Termeni asociați:
- Fosfoproteina
- Colipaza
- Trigliceride
- Lipaza gastrică
- Hidroliza enzimatică
- Lipaza
- Gene imbricate
- Digestie
- Pierderea în greutate corporală
Descărcați în format PDF
Despre această pagină
Funcția pancreatică
2 lipaze
Lipaza pancreatică este secretată într-o formă activă, dar activitatea sa este sporită de sărurile biliare. Sărurile biliare sporesc eficiența lipolizei prin creșterea suprafeței interfețelor ulei-apă la care lipaza solubilă în apă este eficientă. Colipaza este o proteină mică, sintetizată în pancreas, care permite lipazei pancreatice să funcționeze în ciuda concentrațiilor micelare de săruri biliare conjugate. Sărurile biliare în sine împiedică adsorbția lipazei pe trigliceride prin acoperirea întregii interfețe apă-substrat. Colipaza tinde să prevină acest lucru și acționează ca o ancoră pentru adsorbția lipazei, permițând astfel lipazei să hidrolizeze substratul (Vandermeers-Piret și colab., 1977). Calciul poate fi necesar pentru activarea lipazei (Janowitz și Banks, 1976).
Lipaza pancreatică prezintă o activitate optimă în condiții alcaline și hidrolizează trigliceridele în acizi grași și glicerol, dar mono- și digliceridele sunt, de asemenea, produse finale. Lipaza pancreatică are o activitate mai mare împotriva lanțului scurt decât trigliceridele cu lanț lung (Cohen și colab., 1971).
Fosfolipazele A și B sunt prezente și în sucul pancreatic. Fosfolipaza A desparte un acid gras de lecitină sau cefalină pentru a forma lizolectină și lizocefalină. Fosfolipaza B este capabilă să despartă un acid gras și lizolectina pentru a forma glicerilfosforil-colină.
Esterul hidrolazei colesterolului pancreatic catalizează hidroliza esterilor colesterolului alimentar din lumenul intestinal. Colesterolul liber produs, împreună cu colesterolul liber din dietă și din bilă, este preluat de celulele absorbante intestinale. Aici este reesterificat în esteri de colesterol și aceștia sunt transportați în limfă în chilomicroni (Gallo și colab., 1977). Eliminarea secreției pancreatice din intestinul câinilor a redus nivelul esterului colesterolului din limfa lor (Hernandez și colab., 1955).
Enzimologia la interfața membrană: enzimologia interfațială și legarea de proteină-membrană
E. Mateos-Diaz,. F. Carrière, în Methods in Enzymology, 2017
3.2 Construirea unui model pentru orientarea lipazei la o interfață lipidă-apă
Deși lipaza pancreatică este lipaza structurii 3D cunoscute cu cea mai complexă arhitectură (două domenii; un cofactor de proteine), este deosebit de utilă pentru încercarea de a defini o orientare interfațială comună a tuturor lipazelor în absența datelor experimentale care să documenteze orientarea enzimei/pătrunderea la suprafața agregatelor lipidice și fără rularea simulărilor de dinamică moleculară. Un model general pentru orientarea lipazelor la o interfață lipidă-apă poate fi dedus din omologiile structurale combinate ale HPL cu alte lipaze (pli comun α/β-hidrolază) pe de o parte și domeniile de legare a lipidelor pe de altă parte.
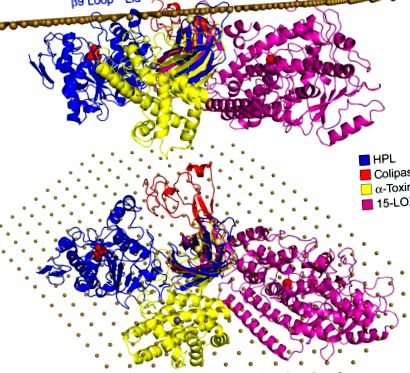
FIG. 4. Structuri 3D de enzime cu domenii PLAT/C2 aliniate pe o supusă interfață. Structura 3D a HPL (trasarea Cα a panglicii albastre, conformație deschisă) a fost orientată astfel încât bucla β9, capacul și bucla β5 ′ să fie în contact cu planul de interfață, materializat de o serie de atomi de carbon distanți la 6 Å (sfere maronii). În această orientare, fragmentul hidrofob al colipazei (urmărirea Cα roșie) vine, de asemenea, în contact strâns cu planul. 15-lipoxigenază de iepure (15-LOX; trasare Cα cu panglică purpurie) și toxina α/fosfolipază C a Clostridium perfringens (trasare Cα cu panglică galbenă) au fost aliniate pe domeniul C-terminal HPL β-sandwich pe baza omologiei N-terminalului și, respectiv, domenii C-terminale.
Un model molecular al complexului HPL/colipază la o interfață presupusă poate fi construit din omologia structurală cu domeniul de legare a lipidelor cPLA2 C2 și orientarea acestui domeniu la suprafața lipozomilor dedusă din spectroscopia fluorescenței triptofanului (Perisic, Paterson, Mosedale, Lara-Gonzalez și Williams, 1999) și studii SDSL - EPR (Ball, Nielsen, Gelb și Robinson, 1999) (Fig. 4). Bucla β5 ′ și buclele hidrofobe din domeniul N-terminal (capac și bucla β9) sunt aliniate cu planul de interfață, precum și partea N-terminală și reziduurile hidrofobe ale colipazei (Fig. 4). Când structurile 3D ale 15-lipoxigenazei de iepure și ale toxinei C. perfringens sunt suprapuse cu HPL pe baza domeniului lor omolog C2/PLAT, se poate observa că domeniile lor catalitice respective se găsesc aproape de planul de interfață (Fig. 4 A) ., iar accesul la situl lor catalitic este rotit spre plan (Fig. 4 B).
Modelul pentru orientarea HPL la o supusă interfață lipidă-apă permite în continuare orientarea celorlalte lipaze pe baza pliului lor conservat de α/β hidrolază. Suprapunerea structurilor HPL, DGL, RML, TLL și TrCut 3D arată cum capacul din conformația deschisă vine în contact strâns cu planul de interfață, indiferent de lipază (Fig. 3 A și B) și expune reziduuri hidrofobe care înconjoară activul intrarea amplasamentului și orientarea către interfață (Fig. 5). Acest model de orientare poate fi utilizat în continuare pentru a analiza contribuția reziduurilor hidrofobe la IRS a fiecărei lipaze pe baza structurilor cristaline obținute în prezența surfactanților și a inhibitorilor.
FIG. 5. Structuri 3D ale lipazelor în complex cu inhibitori și surfactanți la o interfață presupusă. Orientarea lipazei este aceeași ca în Fig. 3 cu vedere laterală în (A) - (F) și vedere de sus în (A ′) - (F ′). Toate lipazele sunt prezentate ca trasare a benzii albastre a Cα, cu excepția atomilor de serină din situsul activ care sunt arătați ca sfere roșii. Reziduurile hidrofobe expuse la deschiderea capacului, agenții tensioactivi și inhibitorii legați covalent sunt prezentate sub formă de sfere gri, verde și, respectiv, cian. (A) A ′: HPL deschis cocristalizat cu alchil fosfonat C11 și BOG. (B) B ′: lipaza pancreatică porcină deschisă (PPL) cocristalizată cu TGME. (C) C ′: RML deschis. (D) D ′: deschis DGL cocristalizat cu alchil fosfonat C11Y4 și BOG. (E) E ′: TLL deschis cocristalizat cu acid oleic. (F) F ′: TrCut deschis cocristalizat cu alchil fosfonat C11 și BOG.
Aplicații de imunotest în diagnosticul veterinar
Thomas P. O'Connor Jr.,. Erwin Workman, în The Immunoassay Handbook (Ediția a patra), 2013
Tehnologia de testare
Testele de lipază pancreatică canină și felină sunt disponibile fiecare în două formate ELISA imunometrice (sandviș), un test cantitativ pe plăci de microtitrare și un test de calitate a dispozitivului SNAP calitativ. Aceste teste sunt concepute pentru a oferi o măsură a lipazei pancreatice specifice imunoreactive în probele de ser. Testele utilizează anticorpi monoclonali care reacționează la diferiți epitopi ai lipazelor pancreatice canine și feline. Un anticorp de captare este imobilizat pe o fază solidă (godeuri de microtitrare sau particule) și un anticorp de detectare sau conjugat se face folosind peroxidază de hrean (HRPO). Anticorpul conjugat se amestecă cu proba și se aplică dispozitivului SNAP sau godeului de microtitrare. Dacă este prezent în eșantion, cPL sau fPL leagă anticorpul de detectare HRPO conjugat și anticorpul de captare care este fixat pe suprafața dispozitivului. După spălare și adăugarea substratului, se formează un produs de reacție de culoare albastru, care este proporțional cu cantitatea de cPL sau fPL prezentă în probă.
Testele pentru formatul plăcii de microtitrare utilizează un set de 5 calibratoare, care sunt rulate cu fiecare test pentru a construi o curbă de calibrare. Nivelurile de cPL sau fPL sunt determinate prin măsurarea valorilor de absorbanță produse de probe și corelarea acestora cu curba standard. Se fac seturi separate pentru aplicații canine (Spec cPL ® Test) și feline (Spec fPL ® Test) deoarece imunoreactivitatea și intervalele de referință sunt diferite pentru fiecare specie.
Testele SNAP (SNAP ® cPL ™ și SNAP ® fPL ™) încorporează un punct de referință care este adiacent punctului de diagnostic (punct de lipază specific pancreasului) și este utilizat pentru a determina nivelurile de lipază pancreatică într-un eșantion de pacient (Fig. 3). Dacă pata de diagnostic este un albastru mai puțin intens decât pata de referință, nivelurile de lipază pancreatică sunt considerate normale. Dacă pata de diagnostic este de un albastru similar sau mai intens, este probabil ca nivelurile de lipază pancreatică să fie crescute.
FIGURA 3. Dispozitiv de testare a lipazei pancreatice SNAP.
- Protein Energy Ratio - o prezentare generală Subiecte ScienceDirect
- Valoarea proteinelor - o prezentare generală Subiecte ScienceDirect
- Pentatrichomonas hominis - o prezentare generală Subiecte ScienceDirect
- Snack Bar - o prezentare generală a subiectelor ScienceDirect
- Fluidul peritoneal - o prezentare generală Subiecte ScienceDirect