Natalia Bello
Departamentul de Reumatologie, Spitalul Cochin, AP-HP, Paris, Franța
Departamentul de Reumatologie, Spitalul General Gregorio Marañón, Madrid, Spania
Adrien Etcheto
Departamentul de Reumatologie, Spitalul Cochin, AP-HP, Paris, Franța
INSERM (U1153): Epidemiologie clinică și biostatistică, PRES Sorbornne Paris-Cité, Paris, Franța
Caroline Béal
Departamentul de Reumatologie, Spitalul Cochin, AP-HP, Paris, Franța
Maxime Dougados
Departamentul de Reumatologie, Spitalul Cochin, AP-HP, Paris, Franța
INSERM (U1153): Epidemiologie clinică și biostatistică, PRES Sorbornne Paris-Cité, Paris, Franța
Anna Moltó
Departamentul de Reumatologie, Spitalul Cochin, AP-HP, Paris, Franța
INSERM (U1153): Epidemiologie clinică și biostatistică, PRES Sorbornne Paris-Cité, Paris, Franța
Abstract
fundal
Fibromialgia (FM) poate coexista cu spondiloartrita (SpA) ducând la dileme de diagnostic și tratament, în special în prezența entezitei. Cu acest studiu am urmărit să estimăm prevalența FM în SpA și să comparăm caracteristicile clinice/de boală și inhibitorii TNF (TNFi) la pacienții cu/fără FM.
Metodă
FM a fost definit de un scor => 5/6 al instrumentului de screening rapid pentru fibromialgie (FiRST). Pacienții SpA (conform reumatologului) și consultarea consecutivă în spitalul de zi, dar și în ambulatoriu la secția de reumatologie a unui spital universitar de îngrijire terțiară au fost incluși.
Demografia, caracteristicile bolii, activitatea și severitatea și tratamentul TNFi au fost comparate la pacienții cu și fără FM; rata de retenție a primului TNFi și factorii asociați au fost explorate (regresia Kaplan Meier și Cox).
Rezultate
Dintre cei 196 de pacienți înscriși la SpA, 42 (21,4%) au fost depistați pozitiv pentru FM. Nu s-au găsit diferențe semnificative statistic în prevalența FM în ceea ce privește îndeplinirea criteriilor ASAS pentru SpA periferic/axial și nici în ceea ce privește îndeplinirea imagisticii vs. brațul clinic al criteriilor ASAS. Cu toate acestea, pacienții cu FM coexistentă s-au prezentat semnificativ cu mai multă entezită, activitate mai mare a bolii (BASDAI și VAS) și scoruri funcționale mai slabe (BASFI). Nu s-au găsit diferențe în ceea ce privește inițierea tratamentului cu TNFi (79,0% vs. 70,0%, respectiv), dar rata de retenție a primului TNFi după 2 ani a fost mai mică în grupul de pacienți cu FM (28,1% (IC 95%) ) 12,5-44,0) vs. 41,7% (IC 95% 32,2-51,3), p = 0,01).
Concluzie
Acest studiu confirmă faptul că FM coexistență în SpA ar putea avea impact asupra indicilor de rezultat raportați de pacient pentru activitatea și funcția bolii, precum și rata de retenție a tratamentului TNFi.
fundal
Spondiloartrita (SpA) este o boală care include un spectru de entități inflamatorii cronice care implică scheletul axial (articulațiile sacroiliace și coloana vertebrală) și articulațiile periferice și care împărtășesc o serie de caracteristici clinice, cum ar fi artrita, entezita, uveita, dactilita, psoriazisul și boală inflamatorie intestinală cu fond genetic comun, antigenul leucocitar uman (HLA) B27 [1-4]. În 2009, Evaluarea Societății Internaționale a Spondiloartritei (ASAS) a propus un nou set de criterii de clasificare cu scopul de a recunoaște pacienții cu SpA axială timpurie (axSpA) incluzând pentru prima dată imagistica articulațiilor sacroiliace (SIJ) prin rezonanță magnetică imagistică (RMN) și proteine C-reactive anormale (CRP) [5] și un alt set pentru pacienții cu SpA cu manifestări predominant periferice (de exemplu, artrită periferică, entezită și dactilită) [6, 7]. Criteriile axSpA permit clasificarea pacienților cu dureri de spate cronice care durează ≥ 3 luni și care apar înainte de 45 de ani, prin două brațe: brațul imagistic în care pacienții prezintă sacroiliită (fie pe radiografii sau RMN) plus cel puțin un suplimentar Caracteristica SpA și brațul clinic în care pacienții trebuie să fie HLA-B27 pozitivi și să prezinte două sau mai multe caracteristici SpA.
Cu toate acestea, brațul clinic a fost criticat și nu este bine recunoscut de autoritățile noastre de sănătate și nici de unii colegi, în ciuda faptului că a fost validat pe deplin [8]. Principalul argument pentru o astfel de critică este că acest braț ar permite clasificarea SpA la pacienți fără niciun semn obiectiv de inflamație (CRP anormală sau prezența leziunilor inflamatorii observate la RMN al SIJ) sau leziuni structurale în SIJ observate pe radiografiile pelvine [ 6, 9].
Într-adevăr, deși s-a dovedit că criteriile ASAS sunt extrem de specifice, cu sensibilitate acceptabilă atât pentru diagnostic cât și pentru clasificarea pacienților cu SpA [10, 11], s-ar putea considera necorespunzător aplicarea lor ca instrument de diagnostic în absența semnelor obiective de deteriorare structurală sau inflamație, datorită riscului potențial de diagnostic greșit sau de supra-diagnosticare a SpA la pacienții cu alte afecțiuni (de exemplu, fibromialgia (FM), în special în prezența entezitei [12].
În absența biomarkerilor specifici pentru FM, diagnosticul poate fi efectuat în prezent utilizând criteriile Colegiului American de Reumatologie (ACR) (clasificarea ACR 1990 a FM și ACR 2010 și criteriile de diagnostic modificate 2010 (2011)) [14, 22, 23] . Cu toate acestea, aceste criterii au fost dezvoltate în scopuri de cercetare și clasificare și sunt dificil de aplicat în practica zilnică, deoarece consumă mult timp și necesită o anumită formare pentru a fi implementate [24]. Mai mult, astfel de criterii (de exemplu, ACR 1990) integrează puncte de licitație la examinarea fizică care ar putea reflecta entezita la pacienții cu SpA. Prin urmare, cu obiectivul de a identifica un instrument de screening ușor și valid pentru a facilita identificarea pacienților cu FM în practica și cercetarea clinică, a fost dezvoltat instrumentul de screening rapid pentru fibromialgie (FiRST) [25], care are o sensibilitate de 90,5% și specificitatea de 85,7% [25] pentru identificarea pacienților cu FM.
Toate cele de mai sus ne-au determinat să realizăm acest studiu cu scopul de a 1) estima prevalența FM în funcție de FiRST la o populație de pacienți cu SpA și de a compara prevalența cu privire la brațul îndeplinit în cadrul criteriilor axiale (adică imagistica și brațe clinice) și 2) compară caracteristicile demografice/bolii și tratamentul cu inhibitor TNF (TNFi) în ceea ce privește inițierea și prima rată de retenție TNFi, la pacienții cu și fără FM, respectiv.
Metode
Design de studiu
Completarea chestionarelor FiRST, BASDAI și Spondilita anchilozantă funcțională de baie (BASFI) au fost efectuate prospectiv, iar datele privind datele demografice și caracteristicile bolii au fost recuperate retrospectiv din fișele medicale.
Populația de studiu
Au fost incluși pacienții cu vârsta ≥18 ani, care au fost diagnosticați cu SpA (conform reumatologului) și care frecventau consecutiv spitalul de zi, dar și ambulatoriul de la secția de reumatologie a unui spital universitar de îngrijire terțiară.
Colectare de date
FM a fost definit dacă scorul a fost ≥5/6 în primul chestionar [25]. Dosarele medicale ale fiecărui pacient care a completat chestionarul FiRST au fost examinate de doi investigatori externi. Au fost colectate următoarele informații: vârsta, sexul, starea de fumat (trecut, actual, niciodată), greutatea corporală și înălțimea și data diagnosticului SpA, toate articolele disponibile care permit calcularea îndeplinirii criteriilor ASAS; BASDAI [26], scară analogă vizuală globală (VAS) în funcție de pacient, prezența și numărul articulațiilor umflate actuale diagnosticate de un medic și CRP în ziua vizitei au fost colectate și severitatea bolii a fost evaluată la momentul vizita folosind BASFI [27]; Tratamente SpA de la debutul bolii, inclusiv informații despre medicamente antiinflamatoare nesteroidiene (AINS), medicamente antireumatice convenționale care modifică boala (cDMARD) și tipul și numărul de TNFi, numărul de comutatoare, data de începere/sfârșit și motivul întreruperii pentru fiecare TNFi. Au fost colectate informații despre utilizarea trecută sau actuală a medicamentelor psihotrope (de exemplu, miorelaxanți, antidepresive sau anxiolitice), opioide puternice [28, 29] și istoricul depresiei. Nu s-au efectuat imagini (adică ultrasunete sau RMN) special pentru acest studiu.
Considerații de etică
Acest studiu nu a fost prezentat nici unui comitet etic, deoarece a fost realizat folosind datele colectate în îngrijirea de rutină. Cu toate acestea, toți pacienții și-au dat consimțământul oral de a-și folosi datele pentru acest studiu (așa cum se arată în procedurile oficiale naționale franceze pentru studii non-intervenționale).
Manipularea datelor lipsește
În cazul informațiilor lipsă, pacienții au fost contactați telefonic pentru a obține astfel de informații. Dacă CRP nu a fost disponibil în ziua vizitei, a fost utilizată ultima măsurare CRP disponibilă colectată în ultimele 6 luni. Mai mult, dacă lipsea vreunul dintre răspunsurile la chestionarul FiRST, am exclus exclusiv pacienții pentru care răspunsurile lipsă nu ne-au permis să determinăm grupul lor (cu/fără FM), de exemplu, un pacient care a răspuns pozitiv la trei întrebări, dar a nu răspunde la ultimele trei întrebări.
analize statistice
Variabilele continue au fost raportate prin media și deviația standard (SD) și variabilele calitative după frecvență și procent. Semnificația statistică a fost stabilită la testul p 2), după caz.
Procentul pacienților care au fost vreodată expuși la un TNFi, numărul mediu de TNFi primit, durata medie a primului tratament TNFi și motivele întreruperii fiecărui TNFi au fost evaluate în populația totală și comparate în FM +/FM- grupuri. Rata de retenție a primului tratament TNFi în grupurile FM +/FM a fost estimată prin analiza supraviețuirii (curbele Kaplan - Meier) și comparată prin testul log-rank. Factorii predispozanți pentru întreruperea primului TNFi în primii 2 ani au fost evaluați prin modele de regresie Cox mai întâi prin analiza univariată și ulterior prin analiza multivariată, incluzând în model doar variabilele care au avut un test de valoare p 2.
Rezultate
Dintre cei 213 de pacienți care au completat chestionarul FiRST, 196 au fost reținuți pentru analiza noastră: au fost excluși pacienții fără diagnostic confirmat de SpA (n = 14) și pacienții care au răspuns incomplet la chestionar (n = 3). Fiabilitatea diagnosticului FM a fost bună, cu un PABAK = 0,64 (95% CI 0,314; 0,958). În populația noastră SpA, prevalența FM concomitentă a fost de 21,4% (42/196).
Prevalența fibromialgiei în conformitate cu criteriile de clasificare ASAS
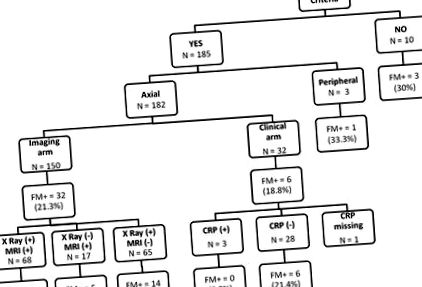
Figura 1 rezumă prevalența FM în funcție de criteriile de clasificare ASAS. Dintre cei 196 de pacienți incluși în analiză, 185 (94,4%) au îndeplinit criteriile ASAS (182 (98,4%) și 3 (1,6%) axial și respectiv periferic). Pentru criteriile ASAS pentru axSpA, 150 de pacienți (82,4%) și 32 de pacienți (17,6%) au îndeplinit brațele imagistice și, respectiv, cele clinice.
Fibromialgia (FM) în spondiloartrită, în funcție de criteriile de clasificare a Evaluării Societății Internaționale a Spondiloartritei (ASAS) și de brațul îndeplinit. Fibromialgia FM + definită de chestionarul Fibromyalgia Rapid Screening Tool (FIRST) (de exemplu, FIRST ≥5/6), sacroiliită radiografică XRay (+), sacroiliită imagistică prin rezonanță magnetică RMN, CRP (+) proteină C-reactivă anormală ( adică ≥6 mg/L)
Prevalența FM concomitentă a fost mai mare în grupul de pacienți care nu îndeplineau criteriile ASAS, deși această diferență nu a fost semnificativă statistic (21,1% față de 30,0%, nu semnificativă). Mai interesant, nu s-au observat diferențe în prevalența FM în grupul de pacienți care îndeplinesc brațele imagistice și clinice ale criteriilor ASAS pentru axSpA (21,3% față de 19%, nesemnificativ).
Demografia, caracteristicile bolii, activitatea și severitatea au fost comparate în grupurile FM + și FM (vezi Tabelul 1). Aceste două grupuri au fost similare în ceea ce privește vârsta, vârsta medie la debutul bolii și starea de fumat. Cu toate acestea, pacienții care îndeplinesc definiția FM + s-au prezentat mai frecvent cu entezită (59,5% față de 39,0%, p = 0,01) și BASDAI total mai mare (4,7 (± 2,3) față de 2,6 (± 1,9), p 2 rezumă caracteristicile tratamentului TNFi în Procentul de pacienți expuși vreodată la TNFi nu a diferit între grupurile FM + față de FM (79% față de 70%, respectiv, nu semnificativ), în timp ce procentul de comutatoare a fost semnificativ mai mare în grupul FM + (15,2 % vs. 4,0%, p = 0,03) Durata medie a primului TNFi a fost semnificativ mai scurtă în grupul FM + (1,7 (± 2,4) față de 3,5 (± 4,0) ani, p 2).
masa 2
Tratamentul cu inhibitor TNF (TNFi) la pacienții cu și fără fibromialgie
Curba Kaplan - Meier pentru rata de retenție a primului inhibitor TNF (TNFi) în primii 2 ani. Fibromialgie FM
Analiza Cox univariată a identificat FM (raportul de pericol (HR) 1,8, 95% CI 1,1; 3,0), implicarea periferică (HR 1,6, 95% CI 1,0; 2,6) și antecedente de depresie sau medicamente psihotrope sau aport puternic de opiacee (HR 0,6, 95 % CI 0,4; 0,9) ca factori asociați pentru întreruperea primului TNFi; cu toate acestea, la analiza multivariată numai FM (HR 1,7, 95% CI 1,0; 2,9) și implicarea periferică (HR 1,6, 95% CI 1,0; 2,6) au fost asociate independent cu întreruperea primului TNFi. Motivele pentru întreruperea fiecărui TNFi au fost procente similare în cele două grupuri (valoarea p nu este semnificativă), ineficiența fiind cel mai frecvent motiv din populația totală.
Discuţie
Din cele mai bune cunoștințe ale noastre, acesta este primul studiu care vizează evaluarea prevalenței FM la o populație de pacienți cu SpA în ceea ce privește îndeplinirea criteriilor de clasificare ASAS, iar rezultatele noastre arată că nu s-au găsit diferențe între imagistica și brațele clinice. a criteriilor ASAS pentru axSpA. Această constatare este un argument în favoarea validității unor astfel de criterii, în special pentru brațul clinic, care încă nu este pe deplin acceptat de unii membri ai comunității științifice. Fenotipul pacienților cu SpA cu FM concomitent a fost mai frecvent feminin și s-a prezentat mai frecvent cu entezită, raportând o activitate mai mare a bolii și scoruri funcționale mai slabe. Aceste rezultate sunt în concordanță cu studiile anterioare [16, 17, 20, 30, 31].
Deoarece pacienții SpA cu FM coexistentă prezintă frecvent un scor mai mare al activității bolii, evaluarea activității bolii și a efectului tratamentului ar putea fi dificilă și ar putea duce la inițierea inutilă a unui TNFi, creșterea dozelor sau comutatoare. În studiul nostru, procentul pacienților care au inițiat un TNFi nu a diferit în grupul FM + și FM–, dar pacienții cu boală FM + concomitentă au fost mai predispuși să treacă la alte tratamente TNFi. Mai mult, rata de retenție a primului TNFi a fost mai scurtă în grupul FM + și prezența FM a fost asociată independent cu o primă întrerupere a TNFi. Acest lucru confirmă faptul că existența FM concomitent în SpA ar putea complica evaluarea răspunsului la tratament [19, 20] și sugerează că coexistența FM trebuie examinată cu atenție la inițierea unui TNFi și/sau la evaluarea efectului tratamentului acestuia, în special în prezența simptome periferice și/sau entezitice și în prezența activității bolii foarte severe și scoruri raportate de pacient. În acest sens, chestionarul FiRST reprezintă un instrument ușor de utilizat și valid care ar putea fi utilizat în practica clinică înainte de începerea unui TNFi, în special la pacienții care prezintă entezită.
Studiul nostru prezintă unele puncte slabe, dar și unele puncte forte. Mai întâi, diagnosticul de FM conform reumatologului nu a fost colectat. Cu toate acestea, am verificat validitatea externă a FiRST în această setare SpA confirmând utilizarea mai mare a medicației psihotrope sau a opioidelor puternice sau istoricul depresiei în grupul de pacienți selectați pozitiv ca FM + [32, 33]. În al doilea rând, a fost raportată recent o sensibilitate mai scăzută a FIRST atunci când este aplicată într-o populație SpA comparativ cu studiul inițial (66% vs. 90%) [34]; cu toate acestea, aceste date nu erau disponibile la momentul începerii studiului. Mai mult, nu am utilizat criteriile ACR (clasificarea ACR 1990 a FM [14] - modificate criteriile preliminare ACR 2010 [22]) pentru a valida rezultatele noastre cu privire la prevalența FM, dar acest lucru s-a datorat complexității aplicării acestor criterii într-un setarea practicii zilnice [23]. În cele din urmă, s-ar putea considera că dimensiunea eșantionului studiului nostru a fost prea mică pentru a trage concluzii certe, de exemplu, în evaluarea ratei de retenție a primului TNFi, doar nouă pacienți au fost expuși riscului după 18 luni de urmărire în FM + grup.
Cu toate acestea, studiul nostru are și unele puncte forte. În primul rând, analizele noastre au fost efectuate pe un număr reprezentativ de pacienți cu SpA în practica zilnică. Mai mult decât atât, din cunoștințele noastre, acesta este primul studiu care vizează evaluarea prevalenței FM în conformitate cu îndeplinirea criteriilor de clasificare ASAS și impactul acesteia asupra tratamentului TNFi.
Concluzii
Pe scurt, procentele similare de FM în diferitele subgrupuri ale criteriilor de clasificare ASAS ar putea fi un argument bun în favoarea validității acestor criterii și, în special, a brațului clinic. Coexistența FM ar putea avea un impact asupra scorului instrumentului utilizat pentru a evalua activitatea și severitatea bolii, în special în scorurile raportate de pacient și, prin urmare, ar putea complica evaluarea răspunsului la tratament. Implementarea chestionarului FiRST ar putea fi utilă în practica clinică, în special în prezența simptomelor entezitice. Alte studii care vizează evaluarea prospectivă a impactului FM concomitent în SpA asupra efectului tratamentului TNFi ar trebui să ne permită să confirmăm (sau nu) constatările noastre.
Mulțumiri
NB a primit o bursă pentru sejururi în străinătate de la Sociedad Española de Rheumatologia pentru realizarea acestui studiu.
- Tratamentul bolilor degenerative, cauze; Simptome
- Efectul tratamentului cu Dapagliflozin asupra expresiei transportorilor renali de sodiu
- Efectul greutății corporale în patogeneza bolii parodontale induse de ligatură la șobolanii Wistar -
- Medicamentul pentru boli hepatice grase poate să nu aibă niciun efect - ScienceDaily
- Co-infecțiile complică diagnosticul și tratamentul bolii Lyme