Abstract
1. Introducere
Țesutul adipos (AT) este un organ secretor activ care reglează echilibrul energetic, homeostazia, apetitul, inflamația, sensibilitatea la insulină, angiogeneza și metabolismul grăsimilor [1]. Metabolismul țesutului adipos și masa totală a grăsimii corporale sunt reglate prin două căi majore: lipoliza (descompunerea grăsimilor) și lipogeneza (sinteza grăsimilor) [2]. Disfuncția țesutului adipos, modificările masei grase și modificările concomitente ale producției de adipokine, citokine inflamatorii și metaboliții lipidici sunt frecvente în tulburările metabolice, cum ar fi rezistența la insulină, diabetul de tip 2, bolile cardiovasculare și cancerele legate de obezitate, cum ar fi colorectal și sân cancer [3,4].
Legătura dintre obezitate și incidența crescută a cancerului este bine stabilită [5,6], dar relația dintre masa grasă și progresia cancerului este mult mai puțin clară. Studiile indică faptul că majoritatea pacienților cu cancer se confruntă cu un anumit grad de risipire a mușchilor și/sau a grăsimii legate de cancer în timpul traiectoriei bolii [7]. Cu toate acestea, se știe puțin despre importanța pierderii de grăsime în cancer, deoarece majoritatea studiilor privind irosirea asociată cancerului se concentrează de obicei pe mușchi. Au fost identificate legături potențiale între pierderea de grăsime și rezultatele slabe care indică pierderea de grăsime ca fiind un factor de prognostic slab în cancerul avansat, indiferent de greutatea corporală a pacientului [8,9]. Acest articol trece în revistă cunoștințele actuale despre epuizarea țesutului adipos în cancer, concentrându-se atât pe evaluarea țesutului adipos, cât și pe determinarea morfologică a țesutului adipos la populațiile de cancer. Sunt discutate și posibilele mecanisme de pierdere a grăsimii. Modificările biologice ale metabolismului țesutului adipos preced manifestarea fizică a pierderii țesutului adipos. Astfel, înțelegerea mecanismelor și a potențialilor markeri ai pierderii de grăsime în cancer sunt importante pentru depistarea precoce, care facilitează prevenirea pierderii ulterioare pentru a păstra grăsimea și a îmbunătăți supraviețuirea la pacienții cu cancer.
2. Atrofia adipoasă în cancer
S-a raportat că pierderea de grăsime este asociată cu un timp de supraviețuire mai scurt [8,9]. Analiza morfologiei țesutului adipos și a compoziției corpului a relevat epuizarea grăsimii corporale la modelele umane și animale ale cașexiei cancerului. În majoritatea studiilor la om discutate în această revizuire, cașexia este definită ca o pierdere în greutate ≥ 5% (WL) în decurs de 3 luni sau ≥ 10% în ultimele 6 luni. Pierderea în greutate nu reflectă neapărat severitatea cașexiei și pierderii de grăsime, dar este prima măsurare a rezultatului utilizată în mod obișnuit în studiile de cancer. Apar date validate pentru clasificarea cașexiei pe baza consensului recent [10].
Adenocarcinomul murin (MAC16) determină scăderea dimensiunii adipocitelor cu densitate mitocondrială crescută și fibroză crescută a țesutului adipos la șoarecii cahectici, comparativ cu animalele hrănite în pereche și de control [11]. Carcinomul Walker 256, un model bine stabilit de cașexie a cancerului, afectează țesutul adipos într-o manieră dependentă de timp și depozit [12,13,14]. La șapte zile după injectarea tumorii Walker 256, nu s-au observat modificări semnificative ale dimensiunii adipocitelor. Cu toate acestea, după 14 zile, dimensiunea adipocitelor țesutului adropos retroperitoneal și epididimal a scăzut. Pe de altă parte, țesutul adipos mezenteric nu s-a pierdut, iar dimensiunea adipocitelor mezenterice a crescut după 14 zile [13,14]. În sprijinul acestor studii experimentale, s-a raportat reducerea volumului de celule grase la pacienții cu cancer gastrointestinal (GI) care slăbesc [15,16,17]. Pacienții cahectici au prezentat adipocite mai mici comparativ cu martorii stabili în greutate [15,16,17,18] și pacienții necanceri [16], dar numărul total de celule adipoase corporale nu a fost modificat [16,17]. Colectiv, aceste studii sugerează modificarea dimensiunii adipocitelor și capacitatea redusă de stocare a lipidelor în prezența unei tumori.
3. Evaluarea țesutului adipos pe traiectoria cancerului
Compoziția corpului este evaluată la pacienții cu cancer utilizând o varietate de metode, inclusiv analiza impedanței bioelectrice (BIA), absorptiometria cu raze X cu energie duală (DEXA), imagistica prin rezonanță magnetică (RMN) și analiza scanării tomografiei computerizate (CT) [21]. Analiza compoziției corporale utilizând BIA a demonstrat scăderea grăsimii corporale (% sau kg) la pacienții cu cahectică, comparativ cu controalele de cancer cu greutate stabilă [15,16,17,22], controalele sănătoase [23] sau controalele non-maligne [16,22 ]. Când DEXA a fost aplicat pacienților cu cancer paliativ subnutriți, nu s-au observat diferențe în masa absolută de grăsime (kg) în timpul urmăririi (4-62 luni) [9]. Cu toate acestea, modificarea relativă (procentul de modificare față de valorile inițiale) a relevat o pierdere de grăsime concomitentă cu o creștere marginală a masei slabe în timpul progresiei cancerului [9]. Deoarece DEXA cuantifică masa corporală slabă regională, acest studiu a ridicat posibilitatea ca pacienții să nu fi câștigat mușchi scheletic în sine, ci mai degrabă masă slabă în organele interne, cum ar fi ficatul și splina, care a fost raportată în timp ce pacienții se apropiau de moarte într-un studiu ulterior [ 24].
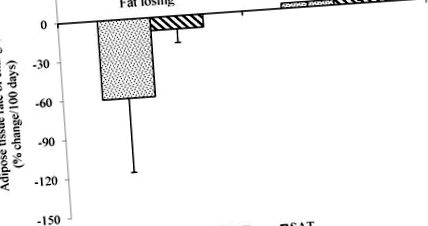
Rata medie a modificării țesutului adipos visceral (TVA) și a țesutului adipos subcutanat (SAT) la pacienții cu cancer care pierd grăsime, evaluată prin scanări consecutive de tomografie computerizată (CT). Datele sunt reprezentate ca media ± SD, n = 5 (pierderea grăsimii) și n = 2 (grăsime stabilă), p 3 luni înainte de deces [36]. Aceste rezultate vor iniția cercetări suplimentare cu scopul de a defini momentul potrivit pentru inițierea intervenției nutriționale pentru a păstra atât mușchii, cât și țesutul adipos.
tabelul 1
Articole care raportează pierderea de grăsime și țesut slab la pacienții nou diagnosticați cu cancer.
| Fouladiun și colab., [9] | Pacienții subnutriți (n = 132; 66 ± 3 ani) au prezentat cancer cu malnutriție (T4N1M1) | GI (n = 123) Sân (n = 1) Melanom (n = 2) Altele (n = 6), urmate timp de 6-42 luni | DEXA | Pierderea de grăsime din întregul corp a fost legată de supraviețuirea mai scurtă Pierderea de grăsime corporală este mai intensă și mai pronunțată în comparație cu țesutul slab |
| Agusstson și colab., [15] | Pacienți cu cancer stabil în greutate (n = 11), pacienți cu cancer cahectic slăbit cu (n = 8) și fără (n = 7) malnutriție | Cancerul GI fără tratament înainte de operație | BIA | Nu există diferențe în masa corporală slabă între grupuri Creșterea lipolizei la pacienții cu cancer cahectic |
| Dahlman și colab., [17] | Pacienți cahectici (n = 13) Cancer stabil în greutate (n = 14) | Cancerul GI fără tratament înainte de operație | BIA | Scăderea masei de grăsime corporală, dar a masei corporale slabe similare între pacienții cahectici și cei de control |
| Ryden și colab., [16] | Pacienți cahectici (n = 13) Pacienți cu cancer stabili în greutate (n = 10), Fără cancer (n = 5) | Cancerul GI fără tratament înainte de operație | BIA | Nicio diferență în masa corporală slabă între grupuri Lipoliza crescută fără modificări ale lipogenezei Fără inflamație locală |
| Agustsson și colab., [26] | Cancer cachectic fără (n = 13) și cu obstrucție gastro-intestinală (n = 10), pierdere în greutate-cancer (n = 17) | Cancerul GI fără tratament înainte de operație | BIA, CT | Nu s-au observat modificări ale masei slabe Volumul de grăsime viscerală a fost mai mic în grupul cahectic comparativ cu greutatea stabilă |
1 Niciun pacient nu a primit chimioterapie sau radioterapie.
4. Mecanisme pentru epuizarea adipoasă în cancer
Cheltuielile energetice crescute, consumul scăzut de alimente și modificările nivelurilor circulante ale hormonilor, inclusiv insulina, leptina, catecolaminele, precum și catabolismul crescut datorită prezenței tumorii (cereri mari de energie ale tumorii, mediatori inflamatori produși de tumoră) și interacțiunile tumoră-gazdă factori care contribuie la risipa cancerului [40]. Acești factori pot provoca anomalii în metabolismul lipidic, care pot duce, de asemenea, la pierderea de grăsime. Creșterea activității lipolitice, evidențiată de glicerol plasmatic crescut în post și de acizi grași liberi este un factor determinant al pierderii de grăsime la pacienții cu cancer avansat [15,23,41], dar nu se cunosc cauzele care stau la baza lipolizei crescute. Au fost atribuite și alte mecanisme, inclusiv scăderea lipogenezei [42,43], afectarea adipogenezei [11,14], oxidarea crescută a grăsimilor [17,23,44] și scăderea depunerii de lipide [45,46,47,48,49] la pierderea de grăsime în cancer (Figura 2).
Rezumatul mecanismelor și genelor specifice implicate în atrofia adipoasă în cancer. WAT, țesut adipos alb; FFA, acizi grași liberi; ATGL, lipidă trigliceridă adiposă, HSL, lipază sensibilă la hormoni; PGC-1α, receptor activat de proliferator peroxizom-coactivator gamma 1 alfa; UCP, proteine de decuplare; CIDEA, efector A ca DFFA (factor de fragmentare a ADN-alfa) inducător de moarte celulară; CPT1α, carnitina palmitoiltransferaza 1 alfa; PPAR-γ, receptor gamma activat de proliferator Peroxisom; C/EBPα, proteină a care leagă amplificatorul CCAAT; LPL, lipoproteină lipazică; FAS, acizi grași sintaza; ACC, acetil-CoA carboxilaza; Scd1, desearază Stearoyl-CoA; SREBP1c, un element regulator al sterolului care leagă proteina-1c.
Modele umane și experimentale au fost utilizate pentru a studia mecanismele pierderii de grăsime în cancer. Modelele animale sunt necesare pentru a ne înțelege mai bine pierderea în greutate asociată cancerului. Cu toate acestea, fiecare model poate reprezenta doar unele aspecte ale cașexiei cancerului uman, iar alegerea modelului animal se bazează pe obiectivele cercetării. De exemplu, adenocarcinomul MAC16 induce cașexia în absența anorexiei și este potrivit pentru a studia risipa legată de factorii produși de tumoare, mai degrabă decât de aportul alimentar. Hoshoma ascită Yoshida hepatom AH130 (YAH-130), pe de altă parte, induce cașexie și anorexie însoțite de inflamație [50]. Prin urmare, rezultatul studiilor care investighează mecanismele care stau la baza pierderii de grăsime în cancer ar trebui interpretat cu precauție, deoarece fiecare tip specific de tumoră, în diferite stadii de creștere, poate afecta diferite depozite de țesut adipos într-un mod diferit.
4.1. Scăderea consumului de alimente și hipermetabolism
La pacienții cu cancer paliativ, în perioada de urmărire de 4–62 luni, greutatea corporală și masa de grăsime (% variație față de valoarea inițială) au scăzut în absența modificărilor REE. În ciuda oferirii de sprijin nutrițional pacienților care au avut un aport de calorii inițial mai mic de 90% din necesarul lor de energie, greutatea corporală și masa de grăsime nu au crescut [9]. Prin urmare, alți factori decât aportul de nutrienți și hipermetabolismul pot contribui la pierderea de grăsime în cancer.
4.2. Lipoliza și oxidarea crescută a grăsimilor
Este bine acceptat faptul că lipoliza crescută este principala cauză a pierderii de grăsime în cancer [15,16,17,22,23,55,56], totuși mecanismele specifice care contribuie la lipoliză nu au fost clar definite. Lipaza sensibilă la hormoni (HSL) și trigliceridele lipidice adipoase (ATGL) sunt enzime majore care contribuie la descompunerea TG în țesutul adipos. Lipidul triglicerid lipidic catalizează primul pas în hidroliza TG. În timpul lipolizei țesutului adipos, acizii grași liberi (FFA) și moleculele de glicerol sunt produse prin hidroliza trigliceridelor. Activitatea HSL este reglată de hormoni, adică catecolamine, insulină și glucagon, printr-un proces mediat de AMPc [57,58]. Catecolaminele stimulează lipoliza, în timp ce insulina are funcții anti-lipolitice [59]. Legarea hormonilor de receptorii cuplați cu proteina G are ca rezultat reglarea în sus a adenilat ciclazei, ceea ce duce la o creștere a concentrațiilor intracelulare ciclice de adenozin monofosfat (AMPc). AMPc stimulează o proteină kinază care la rândul său fosforilează și activează HSL [57,58]. HSL fosforilat se translocează de la citosol la suprafața picăturilor de lipide pentru a induce lipoliza.
4.3. Lipogeneza și depunerea lipidelor
În ciuda importanței lipolizei în pierderea de grăsime în cancer, epuizarea grăsimilor poate apărea și atunci când lipogeneza este limitată în țesutul adipos alb. La modelele cachectice murine (hepatom ascitic Yoshida AH-130), scăderea lipogenezei AT a fost însoțită de o creștere a lipogenezei hepatice și a hipertrigliceridemiei [42]. Scăderea lipogenezei a fost însoțită de activități mai scăzute ale FAS, enzimei de scindare a citratului și enzimei malice la șobolanii care au un adenocarcinom mamar în fazele tardive ale progresiei tumorale [43]. Deteriorarea capacității de sinteză lipidică a țesutului adipos epididimal a fost observată la șobolanii purtători MAC16, evidențiată de scăderea nivelului de ARNm de enzime lipogene importante precum acetil-CoA carboxilaza, FAS, stearoil-CoA desaturază-1 și glicerol-3-fosfat aciltransferază [11].
Creșterea lipolizei și scăderea lipogenezei au fost raportate la iepurii albi masculi japonezi care poartă celulele tumorale VX2 comparativ cu animalele cu restricție alimentară. Reducerea greutății corporale și pierderea de grăsime au apărut înainte de orice scădere a aportului de alimente [65]. Apoptoza adipocitelor (20-30 de zile după implantarea tumorii) a fost de asemenea observată în grupurile tumorale, cu toate acestea nu au fost raportate modificări ale numărului total de celule de grăsime corporală în studiile anterioare la om [15,16,17]. Discrepanțele pot fi cauzate de faptul că pacienții din studiile anterioare se aflau în stadiile incipiente ale bolii și, de asemenea, numărul de celule grase a fost extrapolat pe baza grăsimii totale corporale și a volumului mediu de celule grase. Spre deosebire de aceste studii la om, animalele au fost urmărite în timpul progresiei cancerului și, de asemenea, diferențele biologice și limitările rezultatelor extrapolării între diferite specii pot contribui la discrepanțe.
LPL mediază absorbția FA în țesutul adipos prin hidroliza lipoproteinelor cu densitate foarte mică și a chilomicronilor. Numeroase studii pe animale sugerează reducerea activității LPL în cancer [42,43,45,46]. Reducerea activității AT LPL la șoarecii purtători de tumori la nivelurile animalelor înfometate a fost asociată cu depunerea lipidelor afectată, pierderea de grăsime, descompunerea redusă a lipoproteinelor plasmatice și creșterea concentrațiilor de lipide circulante [47]. Scăderea activității LPL a țesutului adipos a fost asociată cu hipertrigliceridemie în stadiile incipiente ale creșterii tumorii la șobolanii Lewis care au un adenocarcinom mamar [43]. Scăderea conținutului de grăsime și a activității LPL în WAT a fost însoțită de creșterea trigliceridelor circulante și de pierderea în greutate corporală indusă de hepatomul de ascită Yoshida AH-130 la șobolani [42,45,46]. La șoarecii care poartă MAC16, TG-urile plasmatice au scăzut în timpul progresiei cancerului, indiferent de cantitatea de pierdere în greutate. În stadiile incipiente, FFA plasmatică a scăzut și activitatea LPL a crescut; cu toate acestea, în stadii avansate ale tumorii, activitatea LPL a scăzut [49].
În timp ce majoritatea studiilor au folosit modele animale pentru a investiga lipogeneza și activitatea LPL în timpul progresiei cancerului, studiile la om au raportat scăderea expresiei mARN-ului și a activității LPL și FAS în TVA în apropierea unei tumori comparativ cu țesutul adipos distal la pacienții cu cancer colorectal [ 48]. Scăderea activității FAS în țesutul adipos și activitatea crescută în celulele tumorale pot fi importante pentru creșterea celulelor tumorale [48]. Nu s-au observat modificări ale lipogenezei adipocitelor izolate din SAT pentru pacienții cu cancer, comparativ cu martorii [16]. TG plasmatic mai scăzut și glicerol și FFA mai mari au fost observate la pacienții cachectici [16,17,27], dar activitatea sau expresia LPL nu a fost determinată în aceste studii. Sunt necesare studii suplimentare pentru a determina capacitatea de lipogeneză și absorbția de acizi grași de către țesutul adipos la diferite grupuri de pacienți cu cancer în diferite stadii ale traiectoriei bolii.
4.4. Adipogeneza
5. Inflamația țesutului adipos local
6. Concluzii
Contribuțiile autorului
Maryam Ebadi și Vera C. Mazurak au contribuit la concepția și conținutul intelectual al lucrării.
Conflicte de interes
Autorii nu declară niciun conflict de interese.
- Tuse! Este Rac
- Ia cineva suplimente de curcumină de curcumă (metabolism, cancer, sânge, calitate) - Ierburi,
- Semne, simptome și complicații ale cancerului de col uterin
- Evidența dietelor cu indice glicemic scăzut Dietele mai bune pentru pierderea în greutate
- Dovezi ale beneficiului Aproape la jumătatea procesului de slăbire MedPage astăzi