1 Programul oncologic de radiații Harvard, Școala medicală Harvard, 75 Francis Street, L2, Boston, MA 02115, SUA
2 Departamentul de Statistică, Universitatea din Connecticut, 215 Glenbrook Road, U-4120, Storrs, CT 06269, SUA
3 Departamentul de Oncologie a Radiațiilor, Institutul Cancerului Dana-Farber și Spitalul Brigham și pentru Femei, 75 Francis Street, L2, Boston, MA 02115, SUA
Abstract
Scop. Creșterea indicelui de masă corporală (IMC) este asociată cu un cancer de prostată cu risc mai mare (PC) la prezentare. Nu se cunoaște dacă creșterea IMC determină, de asemenea, o terapie mai rapidă de supresie a androgenilor (SAST). Materiale și metode. Între 1995 și 2001, 206 bărbați cu PC cu risc nefavorabil au fost tratați cu radioterapie (RT) sau RT și șase luni de terapie de supresie a androgenilor într-un studiu controlat randomizat (RCT). 108 eșec PSA susținut; 51 au primit sAST pentru PSA care se apropia de 10 ng/ml; 49 cu datele IMC au cuprins cohorta de studiu. O analiză de regresie Cox multivariabilă a identificat factori de pretratare asociați cu primirea sAST anterioară. Rezultate. Creșterea IMC a determinat sAST mai devreme (ani median: 3,7 pentru supraponderali/obezi, 6,9 pentru greutatea normală; raportul de risc ajustat (AHR): 1,11; IC 95%: 1,04, 1,18;
) la fel ca PC cu risc crescut față de alte riscuri (mediană: 3,2 față de 5,2 ani; AHR: 2,01; IC 95%: 1,05, 3,83;
). Creșterea timpului median până la sAST a fost observată la bărbații supraponderali/obezi cu PC cu risc crescut față de altul și la bărbații cu greutate normală cu orice PC cu risc de 2,3, 4,6 și respectiv 6,9 ani
pentru tendință). Concluzie. Creșterea IMC a fost asociată cu sAST anterioară. Un RCT care evaluează dacă reducerea IMC întârzie sau elimină nevoia de sAST este justificat.
1. Introducere
Cancerul de prostată (PC) este cel mai frecvent diagnosticat cancer la bărbați și a doua cea mai frecventă cauză de deces prin cancer la bărbați după cancerul pulmonar [1]. Prevalența obezității în populația SUA este în creștere și este legată de creșterea mortalității globale [2, 3]. Indicele mai mare de masă corporală (IMC) a fost demonstrat în mai multe studii la bărbați cu PC asociate cu mortalitate crescută specifică PC [4, 5], risc crescut de eșec al PSA după prostatectomie radicală [6, 7] sau radioterapie cu fascicul extern RT) [8, 9], boală cu risc mai mare la prezentare [10-12] și probabilitate mai mare de boală rezistentă la castrat sau metastaze după terapia de supresie a androgenilor (AST) [13], după ajustarea pentru factorii de risc cunoscuți.
Explicațiile posibile pentru motivul creșterii IMC ar putea promova o boală mai agresivă [14] includ hiperinsulinemia indusă de dietă care duce la creșterea tumorii [5, 15, 16], creșterea estradiolului și concentrații serice scăzute de testosteron la bărbații obezi care produc PC mai agresiv, independent de testosteron astfel de tipuri de cancer ar fi apărut într-un mediu în care testosteronul era scăzut [17, 18], inflamația subclinică cronică [19] sau polimorfismele funcționale cu nucleotide unice [20].
Până în prezent, nu a fost efectuată o evaluare prospectivă în contextul unui studiu controlat randomizat (RCT) care să investigheze dacă există o relație între IMC la randomizare și timpul de salvare a AST (sAST), după RT cu sau fără șase luni de AST pentru bărbații cu PC localizat cu risc intermediar sau ridicat în care sAST a fost administrat dacă PSA s-a apropiat de un nivel prespecificat. Prin urmare, scopul acestui studiu a fost de a examina efectul IMC pretratamentului asupra timpului până la sAST, ajustarea pentru factorii de prognostic PC cunoscuți, vârsta la eșecul PSA, comorbiditatea utilizând metrica de evaluare a comorbidității adulților- (ACE-) 27, [21] și tratament inițial în cadrul unui ECR în care pacienții cu PC defavorizat localizat și local avansat au fost tratați cu RT sau RT și șase luni de AST.
2. Materiale și metode
2.1. Populația și tratamentul pacienților
Între 7 decembrie 1995 și 27 decembrie 2001, 206 bărbați au fost înrolați la un RCT comparând impactul asupra supraviețuirii globale a tratamentului cu RT cu sau fără șase luni de AST. Detalii despre proiectarea studiului și criteriile de includere au fost raportate anterior [22]. În timp ce studiul de cohortă a constat în principal din bărbați cu boală cu risc mediu și NCCN, bărbații cu boală cu risc scăzut au fost incluși dacă au avut dovezi asupra unui studiu de imagistică prin rezonanță magnetică endorectală a invaziei veziculelor seminale sau a extensiei extracapsulare (boala T3). Din 206 de bărbați, 108 au suferit un eșec al PSA (determinat de trei creșteri consecutive ale PSA serice peste nadir) și 51 dintre aceștia au primit sAST. Dintre cei 51 de pacienți, la prezentare, doi pacienți nu aveau date inițiale despre IMC. Prin urmare, cohorta de studiu a constat din restul de 49 de bărbați. sAST a fost administrat în perioada 31 octombrie 1996 și 9 februarie 2011 și a constat dintr-un agonist LHRH pe tot parcursul vieții cu sau fără antiandrogen (
) sau orhiectomie bilaterală (
). Eșecul clinic sau biochimic după SAST a fost gestionat cu o manipulare suplimentară a hormonilor înainte de chimioterapia sistemică. Acest studiu a fost aprobat de Dana Farber/Harvard Cancer Center Institutional Review Board.
2.2. Urmărirea și determinarea cauzei decesului
După încheierea tratamentului, bărbații au fost urmăriți la fiecare trei luni în primii doi ani, la fiecare șase luni în următorii trei ani și anual după aceea. La fiecare urmărire s-a obținut un PSA seric și s-a efectuat un examen rectal digital. sAST a fost administrat conform protocolului când și dacă nivelul PSA s-a apropiat de 10 ng/ml. Pentru a fi considerat că a murit din cauza PC, un pacient a avut nevoie de documentație radiografică a bolii metastatice și a experimentat o creștere a PSA în ciuda tratamentului cu sAST, manevre hormonale secundare și chimioterapie sistemică.
2.3. Metode statistice
2.3.1. Descrierea cohortei de studiu
Statisticile descriptive au fost folosite pentru a crea tabelul 1, care conține distribuția la randomizare a caracteristicilor clinice ale pacienților care au fost supuși sAST. PSA mediană (IQR) măsurată cel mai atent înainte de primirea sAST a fost de 9,7 ng/ml (7,6, 12,1).
2.3.2. Analiza timpului sAST
Obiectivul principal al acestui studiu a fost timpul pentru utilizarea sAST. O analiză de regresie Cox multivariabilă [23] a fost utilizată pentru a stabili dacă factorii clinici la randomizare au fost asociați cu un risc crescut de a primi sAST. În scopul acestui studiu, timpul zero a fost data randomizării. Factorii clinici evaluați au inclus vârsta, IMC și procentul de biopsii pozitive ca covariabile continue și tratamentul primit, scorul de comorbiditate ACE-27 și grupul de risc NCCN ca covariabile categorice. Datorită interacțiunii cunoscute dintre terapia hormonală și scorul de comorbiditate, un termen de interacțiune între tratamentul primit și scorul de comorbiditate a fost inclus în model [22]. Grupurile de bază pentru covariabilele categorice au fost după cum urmează: tratamentul cu RT și AST, fără comorbiditate sau minimă și PC cu risc intermediar. Rapoartele de pericol neajustate și ajustate și intervalele de încredere de 95% asociate, precum și valorile, au fost calculate pentru fiecare covariabil [23]. O valoare bilaterală mai mică de 0,05 a fost considerată semnificativă.
2.3.3. Estimări ale libertății de primire a sAST
Estimările Kaplan-Meier [24] ale libertății de la primirea sAST au fost calculate și afișate grafic, stratificate prin covariabile semnificative care s-au asociat cu un risc crescut de a primi sAST pe analize multivariabile. Comparațiile în perechi ale acestor estimări au fost efectuate folosind un test log-rank [25]. Corecție pentru comparații multiple (
) a fost efectuată utilizând o corecție Bonferroni [26] astfel încât o valoare semnificativă a fost acum mai mică de 0,017. SAS versiunea 9.3 (SAS Institute, Cary, NC) a fost utilizată pentru toate analizele statistice.
3. Rezultate
3.1. Descrierea cohortei de studiu
Tabelul 1 ilustrează distribuția caracteristicilor clinice la randomizare pentru cei 49 de bărbați care au suferit sAST. Majoritatea acestor bărbați erau sănătoși (scor de comorbiditate 80% ACE-27 nu sau minim), iar marea majoritate (79%) aveau PC Gleason 7 sau mai mare. De remarcat, 84% dintre bărbați au avut un IMC de cel puțin 25 kg/m2, clasificându-i ca fiind supraponderali sau obezi și doar 31% au fost randomizați pentru a primi RT și șase luni de AST ca tratament inițial.
3.2. Analiza timpului sAST
Timpul mediu (IQR) până la primirea sAST a fost de 4,0 ani (2,3, 6,2). Așa cum se arată în Tabelul 2, creșterea IMC a fost asociată cu administrarea anterioară a sAST (timp mediu 3,7 față de 6,9 ani pentru supraponderali sau obezi față de greutatea normală; raportul de risc ajustat (AHR): 1,11; IÎ 95%: 1,04, 1,18;). În plus, bărbații cu PC cu risc crescut față de celelalte riscuri (3,2 față de 5,2 ani; AHR: 2,01; 95% CI: 1,05, 3,83;) au primit sAST mai devreme, la fel ca bărbații randomizați inițial la RT (AHR: 2,30; 95% CI: 1,02, 5,18;
3.3. Estimări de libertate de primire a sAST
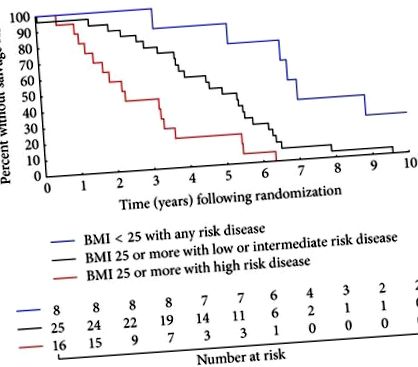
Figura 1 ilustrează impactul semnificativ pe care îl au atât IMC în creștere, cât și grupul de risc NCCN asupra riscului de a primi sAST. Mai exact, s-a observat creșterea timpului mediu până la sAST la bărbații supraponderali/obezi cu PC cu risc crescut față de altul și la bărbații cu greutate normală, cu un PC cu risc de 2,3, 4,6 și respectiv 6,9 ani (pentru tendință).
), IMC> 25 kg/m 2 cu boală cu risc crescut versus IMC> 25 kg/m 2 cu boală cu risc scăzut sau intermediar (
) și IMC> 25 kg/m 2 cu boală cu risc crescut versus IMC 2 cu orice boală cu risc (
În ceea ce privește comparațiile în perechi, bărbații care erau supraponderali sau obezi (IMC> 25 kg/m 2) la randomizare cu boală cu risc ridicat au fost cu cel mai mare risc pentru primirea sAST urmat de bărbații care aveau IMC> 25 kg/m 2, dar scăzut ( cu boală T3 radiografică) sau boală cu risc intermediar (pentru comparație). În schimb, cel mai favorabil grup a fost bărbații cu IMC 2 la randomizare și orice boală cu risc (pentru comparație cu IMC> 25 kg/m 2 și boală cu risc scăzut sau intermediar și pentru comparație cu IMC> 25 kg/m 2 și risc ridicat boală). Estimările punctuale pe cinci ani (IC 95%) pentru lipsa primirii sAST pentru fiecare dintre aceste grupuri variind de la cel mai puțin favorabil la cele mai favorabile au fost 18,8% (4,6%, 40,2%), 44,0% (24,5%, 61,9%) și 87,5% (38,7%, 98,1%).
4. Discutie
În acest studiu am constatat că creșterea IMC a fost asociată cu un timp mai scurt după randomizare pentru a primi sAST în setarea unui RCT potențial în care administrarea sAST a fost necesară conform protocolului dacă și când nivelul PSA s-a apropiat de 10 ng/ml. În plus, am demonstrat asocierea cunoscută între un timp mai scurt până la sAST și tratamentul cu RT numai sau la pacienții care prezintă PC cu risc nefavorabil. Semnificația clinică a constatărilor noastre este că, luând măsuri înainte de diagnosticarea PC pentru a reduce IMC - un factor de risc modificabil - că boala mai avansată la prezentare și rate mai mari de recurență biochimică după tratamentul inițial care sunt asociate cu un IMC ridicat [10-12 ] poate fi redusă sau evitată [27]. Prin urmare, acest studiu ridică ipoteza testabilă conform căreia modificarea stării de sănătate înainte de diagnosticarea PC-ului prin intervenții care indică un IMC mai mic ar putea duce la o boală mai puțin agresivă la prezentare, rate mai mici de recurență, scăderea nevoii de sAST și, prin urmare, un prognostic global mai bun.
Mai multe puncte necesită discuții suplimentare. În primul rând, studiile anterioare au descris beneficiile pentru sănătate ale unui IMC mai mic, rezultând în mod specific îmbunătățiri ale factorilor de risc cardiovascular (cum ar fi colesterolul și tensiunea arterială mai mici), controlul glicemic și longevitatea [28, 29], pe lângă asociațiile cunoscute de cu PC cu risc mai mic, ceea ce prezice un prognostic mai bun și probabil evitarea în avans și/sau sAST [30]. Având în vedere că administrarea AST a fost, de asemenea, asociată cu numeroase evenimente adverse de sănătate [31], inclusiv creșterea în greutate care poate duce la obezitate [32], măsurile preventive pentru reducerea riscului de a deveni obezi susțin îmbunătățirea stării generale de sănătate în plus față de prognosticul după diagnosticul de PC.
Deși nu este posibil aici să se stabilească dacă obezitatea în sine predispune un om la dezvoltarea unui PC mai agresiv sau dacă factorii care predispun un om la obezitate îl predispun și la dezvoltarea unui PC agresiv, ar putea fi avută în vedere un RCT care ajută la discernerea care dintre aceste ipoteze sunt adevărate. Un astfel de studiu ar randomiza bărbații supraponderali sau obezi cu risc crescut de a dezvolta PC (de exemplu, din cauza istoricului familial pozitiv și/sau a etniei afro-americane) la o intervenție de reducere a greutății cu activitate fizică vizată, recomandări dietetice și monitorizarea greutății corporale [28 ], versus nicio intervenție. Acești pacienți ar fi examinați anual cu testarea PSA serică și un examen rectal digital. Analiza grupurilor de risc PC ar fi efectuată la prezentare și rezultate după tratamentul standard. Obiectivul principal ar fi apariția unei boli cu risc ridicat între cele două brațe, cu obiective secundare de eșec al PSA, timpul până la SAST, decesul de la PC și mortalitatea de toate cauzele. Rezultatele ar permite determinarea faptului dacă măsurile care s-au dovedit a fi eficiente în prevenirea obezității [28] pot reduce riscul unui PC mai agresiv la prezentare și rezultate adverse ale PC.
5. Concluzie
În concluzie, am constatat că creșterea IMC a fost asociată cu un timp mai scurt până la sAST după tratamentul inițial cu RT sau RT cu șase luni de AST pentru risc advers de PC. Aceste rezultate susțin dezvoltarea unui ECR menit să identifice dacă măsurile care s-au dovedit a fi eficiente în reducerea IMC pot reduce incidența PC cu risc ridicat la prezentare și pot îmbunătăți rezultatele PC după tratament.
Conflict de interese
Autorii declară că nu există niciun conflict de interese în ceea ce privește publicarea acestei lucrări.
Referințe
- Educarea profesioniștilor din domeniul sănătății în pledoaria pentru prevenirea obezității la copii în rândul lor
- Frontiere de la rezistența obezității la previziune și prevenire a obezității Frontiere în neuroștiințe
- Educarea profesioniștilor din domeniul sănătății în advocacy pentru prevenirea obezității la copii
- Produsele lactate și cancerul ovarian dovezile - Iaurtul în nutriție
- Efectul dietei isocalorice cu conținut scăzut de grăsimi asupra progresiei xenogrefei de cancer de prostată într-o lipsă de hormoni