E. Matthew Morris
Departamentul 1 Medicină - Gastroenterologie și Hepatologie și
Matthew R. Jackman
6 Departamente de Fiziologie și Biofizică, Medicină - Endocrinologie, Diabet și Metabolism, Facultatea de Medicină a Universității din Colorado, Aurora, Colorado
Ginger C. Johnson
6 Departamente de Fiziologie și Biofizică, Medicină - Endocrinologie, Diabet și Metabolism, Facultatea de Medicină a Universității din Colorado, Aurora, Colorado
Tzu-Wen Liu
2 Departamentul de Nutriție și Fiziologie a Exercițiului, Universitatea din Missouri, Columbia, Missouri;
Jordan L. Lopez
6 Departamente de Fiziologie și Biofizică, Medicină - Endocrinologie, Diabet și Metabolism, Facultatea de Medicină a Universității din Colorado, Aurora, Colorado
Monica L. Kearney
2 Departamentul de Nutriție și Fiziologie a Exercițiului, Universitatea din Missouri, Columbia, Missouri;
Justin A. Fletcher
2 Departamentul de Nutriție și Fiziologie a Exercițiului, Universitatea din Missouri, Columbia, Missouri;
Grace M. E. Meers
Departamentul 1 Medicină - Gastroenterologie și Hepatologie și
Lauren G. Koch
4 Departamentul de Anestezie, Universitatea din Michigan, Ann Arbor, Michigan;
Stephen L. Britton
4 Departamentul de Anestezie, Universitatea din Michigan, Ann Arbor, Michigan;
R. Scott Rector
Departamentul 1 Medicină - Gastroenterologie și Hepatologie și
2 Departamentul de Nutriție și Fiziologie a Exercițiului, Universitatea din Missouri, Columbia, Missouri;
3 Harry S. Truman Memorial Veterans Affairs Hospital-Research Service, Columbia, Missouri;
Jamal A. Ibdah
Departamentul 1 Medicină - Gastroenterologie și Hepatologie și
2 Departamentul de Nutriție și Fiziologie a Exercițiului, Universitatea din Missouri, Columbia, Missouri;
3 Harry S. Truman Memorial Veterans Affairs Hospital-Research Service, Columbia, Missouri;
Paul S. MacLean
5 Anschutz Health and Wellness Center, Aurora, Colorado; și
6 Departamente de Fiziologie și Biofizică, Medicină - Endocrinologie, Diabet și Metabolism, Facultatea de Medicină a Universității din Colorado, Aurora, Colorado
John P. Thyfault
Departamentul 1 Medicină - Gastroenterologie și Hepatologie și
2 Departamentul de Nutriție și Fiziologie a Exercițiului, Universitatea din Missouri, Columbia, Missouri;
3 Harry S. Truman Memorial Veterans Affairs Hospital-Research Service, Columbia, Missouri;
Abstract
capacitatea aerobă scăzută sau condiția fizică este un predictor puternic al mortalității cardiovasculare și toate cauzele, independent de alți factori de risc, inclusiv fumatul, obezitatea, bolile cardiovasculare anterioare și diabetul (18, 19). Important, îmbunătățirea condiției fizice crește, de asemenea, în mod semnificativ supraviețuirea la indivizii anterior slabi (19). Capacitatea aerobă este, de asemenea, un predictor independent pentru dezvoltarea sindromului metabolic și a diabetului de tip 2 (12, 34). Capacitatea aerobă scăzută este, de asemenea, un predictor puternic al prevalenței bolii hepatice grase nealcoolice (NAFLD) (2) și are un impact negativ asupra tratamentelor bazate pe stilul de viață pentru NAFLD (16). Cu toate acestea, mecanismul (mecanismele) care leagă capacitatea aerobă scăzută de procesele bolilor metabolice rămâne necunoscut. În special, există date limitate care documentează întregul corp și fenotipurile specifice metabolismului energetic al ficatului care există între grupuri cu capacități aerobe diferite și modul în care aceste fenotipuri diferite pot modula susceptibilitatea pentru NAFLD.
MATERIALE ȘI METODE
Animale.
Modelul de șobolan HCR/LCR a fost dezvoltat și caracterizat așa cum a fost descris anterior (17, 27, 39, 42). La vârsta de 25-30 săptămâni, animalele au fost adăpostite individual și aclimatizate la dieta cu conținut scăzut de grăsimi (D12450B, 10% kcal grăsime; Research Diets, New Brunswick, NJ) timp de ≥ 7 zile înainte de inițierea celor 3 zile HFD (D12451, 45% kcal grăsime; Dietele de cercetare). Aportul alimentar a fost monitorizat zilnic timp de ≥ 3 zile înainte și în timpul HFD de 3 zile. Protocoalele pentru animale au fost aprobate de comitetele instituționale de îngrijire și utilizare a animalelor de la Universitatea din Missouri și de la Universitatea din Colorado Școala de Medicină și Subcomitetul pentru Siguranța Animalelor de la Spitalul pentru Afaceri al Veteranilor Memorial Harry S. Truman.
Analiza compoziției corpului.
Compoziția corpului a fost măsurată prin RMN utilizând EchoMRI-900 (EchoMRI, Houston, TX). Procentul de grăsime corporală a fost calculat ca masa de grăsime împărțită la greutatea animalului. Masa slabă este o valoare determinată analitic de instrument. Masa fără grăsimi (FFM) este diferența dintre greutatea corporală și masa de grăsime. Compoziția corpului a fost determinată imediat înainte de eutanasiere.
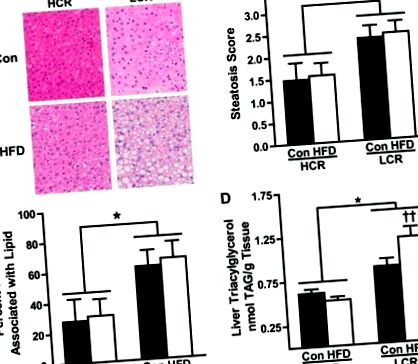
Analiza steatozei.
Monitorizarea metabolică.
Trasor de acizi grași fără dietă de 24 de ore.
Pentru a evalua oxidarea acizilor grași din dietă, reținerea țesuturilor și traficul de grăsimi dietetice și lipogeneza de novo, s-a efectuat un studiu in vivo, cu 24 de ore, cu dublu-trasor, așa cum s-a descris anterior (15, 38). În ziua 2 a HFD de 3 zile, animalele au primit o injecție intraperitoneală de 3 H2O (200 μl, 1 mCi/ml) cu 1 oră înainte de începerea ciclului întunecat, ceea ce permite echilibrarea trasorului cu apa totală din corp și măsurarea de încorporare a tritiului în lipida extrasă servește ca o estimare a retenției nete a carbonului prin lipogeneză de novo. Un raport 4: 1 de oleat [1-14 C] și palmitat [1-14 C] a fost amestecat atât în dieta cu conținut scăzut de grăsimi (LFD), cât și în HFD, rezultând activități specifice de 0,45 și 0,92 μCi/g dietă și 2,04 μCi/g grăsime alimentară), respectiv. Dieta etichetată a fost dată la începutul ciclului final de întuneric. La fiecare 3 ore, CO2 din fiecare cameră a fost colectat într-o alicotă de 3,0 ml dintr-un amestec 2: 1 de metanol și hidroxid de metilbenzetoniu (nr. B2156; Sigma Chemical). Conținutul de 14 C al acestor probe a fost apoi măsurat cu un contor de scintilație Beckman LS6500. La sfârșitul studiului de urmărire de 24 de ore, șobolanii au fost anesteziați cu izofluran și eutanasiați prin exsanguinări pe măsură ce țesuturile erau extrase.
Analiza lipidelor dietetice.
Pentru a determina încorporarea lipidelor tisulare totale 14 C și 3 H, lipidele totale au fost extrase utilizând extracția Dole (4). Două sute de miligrame de ficat și gastrocnemie și 100 mg de tampoane de grăsime (retroperitoneale, epididimale, omentale, mezenterice și inghinale) au fost omogenizate în izopropanol-heptan-1 N H2SO4 (40: 10: 1). Fazele au fost separate cu soluție salină normală, faza superioară a fost colectată și uscată sub N2 gaz și 14 C și 3 H au fost determinate prin numărarea scintilației lichide. 14 C pe probă au fost transformați în miligrame de grăsimi dietetice și s-au normalizat la greutatea probei în grame. Grăsimea alimentară totală a țesutului adipos și hepatic a fost determinată ca grame de grăsimi dietetice per gram de țesut ori de greutatea față de țesut în grame. Grăsimea totală a țesutului muscular scheletic a fost determinată ca grame de grăsimi dietetice per gram de gastrocnemie ori greutatea aproximativă a mușchilor scheletici pentru fiecare șobolan (~ 38% din greutatea corporală) (13). Numărul de 3 H per probă a fost normalizat la greutatea probei în grame.
Izolarea mitocondrială.
Mitocondriile au fost izolate din țesutul hepatic de șobolan, așa cum s-a descris anterior (25). Pe scurt, țesutul a fost omogenizat (teflon pe sticlă) în tampon de izolare mitocondrială hepatică rece (220 manitol, 70 zaharoză, 10 mM Tris și 1 mM EDTA, ajustat la pH 7,4 cu KOH) și centrifugat (1.500 g, 10 min, 4 ° C). Supernatantul a fost centrifugat în serie (8.000/6.000/4.000 g, 10 minute, 4 ° C), cu peleta resuspendată (sticlă pe sticlă) în tampon de izolare mitocondrială hepatică după fiecare centrifugare. Concentrația de proteine a fost determinată prin testul BCA.
Izolarea hepatocitelor, cultura și tratamentul lipidelor.
Respirația mitocondrială.
Consumul de oxigen mitocondrial a fost măsurat utilizând un sistem de electrod de tip Clark (Strathkelvin Instruments, North Lanarkshire, Scoția), așa cum a fost descris anterior (24). Incubațiile au fost efectuate într-un volum final de 0,5 ml menținut la 37 ° C, conținând (în mmol/l) 220 manitol, 70 zaharoză, 10 KH2PO4, 5 MgCl2, 2 HEPES, 1 EGTA, 10 glucoză și 0,2% ser bovin albumina, pH 7,4. Respirația mitocondrială a substraturilor a fost monitorizată la următoarele concentrații: 1 mM malat, 10 mM glutamat și 10 mM succinat. S-au adăugat mitocondrii și substraturi, iar rata maximă de respirație cuplată (starea 3) a fost inițiată prin adăugarea de adenozină 5'-difosfat (ADP; 200 μM). Respirația prin complexul I a fost măsurată cu glutamat (+ malat), în timp ce respirația convergentă prin complexele I și II a glutamatului a fost examinată prin adăugarea de succinat. Respirația maximă decuplată a fost determinată prin titrarea cianurii de carbonil 4- (trifluorometoxi) fenilhidrazonă (1 μM). Consumul de oxigen în nanomoli pe minut a fost normalizat la proteina mitocondrială în celula respirometrului.
Oxidarea palmitatului prin omogenizarea ficatului și mitocondriile izolate.
Oxidarea palmitatului [1-14 C] a fost măsurată în omogenate hepatice proaspete și mitocondrii izolate, așa cum s-a descris anterior (25). Oxidarea acizilor grași a fost evaluată prin măsurarea producției de 14 CO2 (FAO complet) și [14 C] metaboliți solubili în acid (ASM) într-un dispozitiv de captare sigilat la 37 ° C conținând 200 μM palmitat, [1-14 C] palmitat, probă de țesut și tampon de reacție [100 mM zaharoză, 10 mM Tris · HCI, 10 mM KPO4, 100 mM KCl, 1 mM, 4 MgCl2 · 6H2O, 1 mM l-carnitină, 0,1 mM malat, 2 mM ATP, 0,05 mM CoA și 1 mM DTT (pH 7,4)]. Pentru a evalua inducerea FAO completă în mitocondriile hepatice izolate, s-a adăugat ADP (2,5 mM) la godeurile corespunzătoare. Inducerea ADP a FAO completă în mitocondriile izolate a fost reprezentată grafic ca diferență între FAO completă bazală și FAO completă stimulată de ADP.
Oxidarea primară a acizilor grași ai hepatocitelor.
Rata de oxidare a FFA de către hepatocite primare a fost determinată așa cum s-a descris anterior, cu modificări minore (25). După înfometarea serului, plăcile cu 12 godeuri au fost spălate cu PBS cald și celulele incubate cu mediu de reacție [14 C] FFA FAO la 37 ° C timp de 3 ore în triplicat. După 3 ore, mediul din fiecare a fost bine colectat și o alicotă de mediu a fost distribuită în dispozitivul de prindere sigilat. [14 C] CO2 a fost condus din partea alicotă a mediului prin adăugarea de acid percloric și prins în NaOH. NaOH a fost colectat și analizat prin scintilație lichidă numărând pentru determinarea FAO complet la CO2. Mediul acidificat a fost colectat, refrigerat și centrifugat la 16.000 g (4 ° C). O alicotă a fost analizată prin numărarea scintilației lichide pentru determinarea ASM a FAO. Celulele au fost clătite de trei ori cu tampon Krebs-Henseleit răcit cu gheață și lizate cu tampon de liză SDS. Concentrația de proteine a lizatului a fost determinată prin testul BCA.
analize statistice.
Utilizarea substratului întregului corp.
RQ și RQ neproteic (NPRQ) au fost utilizate pentru a estima utilizarea substratului (Fig. 3, A și B). Nu s-au observat diferențe în RQ sau NPRQ între tulpini pe CON. Așa cum era de așteptat, HFD de 3 zile a crescut dependența de utilizarea lipidelor (RQ mai scăzută) în ambele grupuri (P Figura 3D evidențiază aceste diferențe, arătând dispariția substratului ca procent de EI. Diferență foarte mică se observă în partiționarea EI în HCR/LCR șobolani pe CON. Cu toate acestea, HFD de 3 zile a dus la o creștere de ~ 20 de ori a eliminării grăsimilor în HCR, în timp ce LCR a prezentat o creștere minimă (~ 35%). în procentul de EI alocat stocării, în timp ce HCR alimentat cu HFD a crescut stocarea doar de ± 2,5 ori În special, starea ridicată a energiei pozitive în timpul HFD face posibil ca căile metabolice, cum ar fi lipogeneza, să afecteze calcularea oxidării macronutrienților specifici;, substratul datele despre dispariții sunt prezentate numai calitativ pentru a oferi un cadru pentru evaluarea utilizării macronutrienților.
Ca parte a utilizării substratului, au fost, de asemenea, relevate diferențele cheie în tiparele de stocare a energiei. Deși am observat o creștere a stocării energiei atât la șobolanii HCR, cât și la șobolanii LCR în timpul tranziției la un HFD de 3 zile, rata estimată de stocare în LCR a fost de două ori mai mare decât în HCR. Acest lucru este susținut în continuare de creșterea mai mare în greutate de 3 zile și creșterea procentuală a grăsimii corporale în LCR comparativ cu HCR în urma provocării HFD. De asemenea, deși nu a existat nicio diferență în cantitatea de lipide dietetice reținute în ficat, șobolanii LCR s-au observat că au creșteri semnificative ale stocării lipidelor dietetice în tampoanele adipoase inactive din punct de vedere metabolic. Acest lucru este în opoziție cu depozitarea observată a lipidelor dietetice în mușchiul scheletic foarte oxidativ la șobolanii HCR. Aceste modele opuse de trafic de lipide din dietă sunt în concordanță cu diferențele observate în oxidarea acizilor grași din întregul corp și cu diferențele evidențiate anterior în ceea ce privește eficiența metabolică legată de capacitatea aerobă divergentă. În rezumat, aceste date evidențiază faptul că diferențele în capacitatea aerobă intrinsecă au un impact semnificativ asupra tiparelor de stocare a energiei după o tranziție de la o LFD la HFD, factori care urmăresc diferențele de susceptibilitate la steatoză.
În rezumat, demonstrăm că capacitatea aerobă redusă în LCR are ca rezultat o susceptibilitate crescută la steatoza crescută după un HFD acut, un efect asociat cu o creștere mai mare a aportului de energie, un REE ajustat în funcție de greutate, un echilibru energetic crescut, incapacitatea dramatică de a se adapta utilizarea lipidelor la nivelul întregului corp și al ficatului și creșterea stocării grăsimilor alimentare în adipos. În schimb, șobolanii HCR cu capacitate aerobă intrinsecă crescută sunt protejați de steatoza indusă de HFD, o protecție care este asociată cu o cheltuială relativă crescută de energie și cu utilizarea grăsimilor atât in vivo, cât și în ficat. În mod curios, un fenotip metabolic protejat similar a fost observat la subiecții umani care sunt rezistenți la dezvoltarea obezității (8), un covariant major al NAFLD. În concluzie, aceste rezultate evidențiază interacțiunea complexă dintre capacitatea aerobă intrinsecă și metabolismul întregului corp și al energiei hepatice și influența lor asupra susceptibilității la NAFLD.
SUBVENȚII
Această lucrare a fost parțial susținută de subvențiile Institutelor Naționale de Sănătate (NIH) DK-088940; (J. P. Thyfault), 5-T32-AR-48523-8; (E. M. Morris), și DK-038088 (P. S. MacLean) și Veteran Affairs (VA) Grant VA-CD2 BX001299 (R. S. Rector). Sprijinul pentru această activitate a fost, de asemenea, oferit de Centrul de Cercetare a Obezității Nutriționale din Colorado (DK-48520) Laboratorul de Bilanț Energetic. Modelul de șobolan LCR-HCR a fost finanțat de către Oficiul pentru Programe de Infrastructură de Cercetare/OD Grant ROD012098A de la NIH (L. G. Koch și S. L. Britton) și de către NIH Grants RO1-DK-077200; și R01-GM-104194 (S. L. Britton). Această lucrare a fost susținută cu resurse și utilizarea facilităților la Spitalul Memorial Memorial S. S. Truman din Columbia, MO.
DIVULGĂRI
Autorii nu au conflicte de interese, financiare sau de altă natură, de dezvăluit pentru această cercetare.
- Terapia genică hepatică salvează răspunsurile cu diete bogate în grăsimi la șoarecii mutanți Ceas circadieni - ScienceDirect
- Peptidele Kefir ușurează ateroscleroza indusă de dietă bogată în grăsimi - Healthspan Blog - TruDiagnostic
- Pierderea PGC-1α tubulară renală exacerbează steatoza renală indusă de dietă și urinarul legat de vârstă
- Steatoza hepatică, aportul de carbohidrați și consumul alimentar la pacienții cu NAFLD
- Capacitatea de rulare intrinsecă scăzută este asociată cu oxidarea redusă a substratului mușchilor scheletici și