Capacitatea de căldură este o măsură a cantității de energie termică necesară pentru a modifica temperatura unei substanțe pure cu o cantitate dată.
obiective de invatare
Calculați modificarea temperaturii unei substanțe, având în vedere capacitatea sa de căldură și energia utilizată pentru încălzirea acesteia
Chei de luat masa
Puncte cheie
- Capacitatea de căldură este raportul dintre cantitatea de energie termică transferată unui obiect și creșterea rezultată a temperaturii acestuia.
- Capacitatea de căldură molară este o măsură a cantității de căldură necesară pentru a crește temperatura unui mol dintr-o substanță pură cu un grad K.
- Capacitatea de căldură specifică este o măsură a cantității de căldură necesară pentru a crește temperatura unui gram dintr-o substanță pură cu un grad K.
Termeni cheie
- capacitate termică: Capacitatea unei substanțe de a absorbi energia termică; cantitatea de căldură necesară pentru creșterea temperaturii unui mol sau gram a unei substanțe cu un grad Celsius fără nicio schimbare de fază.
- capacitate termică specifică: Cantitatea de căldură care trebuie adăugată sau îndepărtată dintr-o unitate de masă a unei substanțe pentru a-și schimba temperatura cu un Kelvin.
Capacitate de căldură
Capacitatea de căldură este o proprietate fizică intrinsecă a unei substanțe care măsoară cantitatea de căldură necesară pentru a modifica temperatura substanței cu o cantitate dată. În Sistemul Internațional de Unități (SI), capacitatea de căldură este exprimată în unități de jouli pe kelvin [latex] \ left (J \ cdot K ^ \ right) [/ latex]. Capacitatea de căldură este o proprietate extinsă, ceea ce înseamnă că depinde de mărimea/masa probei. De exemplu, o probă care conține cantitatea de substanță dublă decât o altă probă ar necesita dublul cantității de energie termică (Q) pentru a obține aceeași schimbare de temperatură ([latex] \ Delta T [/ latex]) ca cea necesară pentru schimbarea temperatura primei probe.
Capacități de căldură molare și specifice
Există două cantități derivate care specifică capacitatea de căldură ca proprietate intensivă (adică, independentă de mărimea unei probe) a unei substanțe. Sunt:
- capacitatea de căldură molară, care este capacitatea de căldură per mol a unei substanțe pure. Capacitatea de căldură molară este deseori desemnată CP, pentru a indica capacitatea de căldură în condiții de presiune constantă, precum și CV, pentru a indica capacitatea de căldură în condiții de volum constant. Unitățile de capacitate termică molară sunt [latex] \ frac> [/ latex].
- capacitatea de căldură specifică, adesea numită pur și simplu căldură specifică, care este capacitatea de căldură pe unitate de masă a unei substanțe pure. Acesta este desemnat cP și cV și unitățile sale sunt date în [latex] \ frac [/ latex].
Căldură, entalpie și temperatură
Având în vedere capacitatea de căldură molară sau căldura specifică pentru o substanță pură, este posibil să se calculeze cantitatea de căldură necesară pentru creșterea/scăderea temperaturii substanței cu o cantitate dată. Se aplică următoarele două formule:
În aceste ecuații, m este masa substanței în grame (utilizată la calcularea cu căldură specifică), iar n este numărul de moli de substanță (utilizat la calcularea cu capacitatea de căldură molară).
Exemplu
Capacitatea de căldură molară a apei, CP, este [latex] 75,2 \ frac \ cdot K> [/ latex]. Câtă căldură este necesară pentru a crește temperatura de 36 de grame de apă de la 300 la 310 K?
Ni se dă capacitatea de căldură molară a apei, deci trebuie să convertim masa dată de apă în aluni:
Acum ne putem conecta valorile la formula care leagă căldura și capacitatea de căldură:
Interactiv: Vezi căldură specifică și căldură latentă: Capacitatea specifică de căldură este măsura energiei termice necesare pentru creșterea temperaturii unei cantități date de substanță cu un kelvin. Căldura latentă de topire descrie, de asemenea, cantitatea de căldură necesară pentru a topi un solid. Când un solid se topește, temperatura rămâne practic constantă până când întregul solid este topit. Simularea de mai sus demonstrează căldura specifică și căldura latentă.
Tutorial specific capacității termice: Această lecție leagă căldura de o schimbare de temperatură. Se discută despre modul în care cantitatea de căldură necesară pentru o schimbare de temperatură este dependentă de masă și de substanța implicată, iar această relație este reprezentată de capacitatea de căldură specifică a substanței, C.
Calorimetrie cu volum constant
Calorimetrele cu volum constant, precum calorimetrele bombei, sunt utilizate pentru a măsura căldura de ardere a unei reacții.
obiective de invatare
Descrieți cum funcționează calorimetrul unei bombe
Chei de luat masa
Puncte cheie
- Un calorimetru bombă este utilizat pentru a măsura schimbarea energiei interne, [latex] \ Delta U [/ latex], a unei reacții. La volum constant, acesta este egal cu qV, căldura de reacție.
- Calorimetrul are propria capacitate termică, care trebuie luată în considerare atunci când se fac calcule.
Termeni cheie
- calorimetru bombă: Un calorimetru cu bombă este un tip de calorimetru cu volum constant utilizat pentru măsurarea căldurii de ardere a unei anumite reacții.
- calorii: Cantitatea de energie necesară pentru a crește temperatura de 1 gram de apă cu 1 ° C. Este o unitate de energie non-SI echivalentă cu aproximativ 4,18 juli. A Calorie (cu un capital C) = 1000 calorii.
Calorimetrul bombei
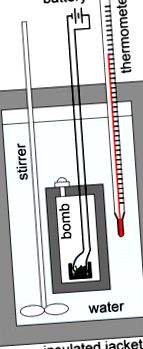
Calorimetria bombei este utilizată pentru a măsura căldura pe care o reacție o absoarbe sau o eliberează și este practic utilizată pentru a măsura conținutul caloric al alimentelor. Un calorimetru bombă este un tip de calorimetru cu volum constant utilizat pentru a măsura căldura de ardere a unei anumite reacții. De exemplu, dacă am fi interesați să determinăm conținutul de căldură al unei role de sushi, de exemplu, am căuta să aflăm numărul de calorii pe care le conține. Pentru a face acest lucru, am plasa ruloul de sushi într-un recipient denumit „bombă”, îl vom sigila și apoi îl vom scufunda în apa din interiorul calorimetrului. Apoi, am evacuat tot aerul din bombă înainte de a pompa în gaz pur de oxigen (O2). După adăugarea oxigenului, o siguranță ar aprinde proba, provocând arderea acestuia, producând astfel dioxid de carbon, apă gazoasă și căldură. Ca atare, calorimetrele bombei sunt construite pentru a rezista presiunilor mari produse din produsele gazoase în aceste reacții de ardere.
Bomba calorimetru: O reprezentare schematică a unui calorimetru bombă utilizat pentru măsurarea căldurilor de ardere. Proba cântărită este plasată într-un creuzet, care la rândul său este plasat în bombă. Proba este arsă complet în oxigen sub presiune. Eșantionul este aprins de o bobină de aprindere cu sârmă de fier care luminează atunci când este încălzită. Calorimetrul este umplut cu lichid, de obicei apă, și izolat cu ajutorul unui sacou. Temperatura apei se măsoară cu termometrul. Din schimbarea temperaturii, se poate calcula căldura de reacție.
Odată ce proba este complet arsă, căldura eliberată în reacție se transferă în apă și calorimetru. Schimbarea temperaturii apei se măsoară cu un termometru. Căldura totală degajată în reacție va fi egală cu căldura câștigată de apă și calorimetru:
Rețineți că căldura obținută de calorimetru este suma căldurii acumulate de apă, precum și calorimetrul însuși. Acest lucru poate fi exprimat după cum urmează:
unde Cwater denotă capacitatea de căldură specifică a apei [latex] \ left (1 \ frac> ^ \ text> \ right) [/ latex], iar Ccal este capacitatea de căldură a calorimetrului (de obicei în [latex] \ frac><^\text>[/ latex]). Prin urmare, atunci când se efectuează experimente de calorimetrie cu bombă, este necesar să se calibreze calorimetrul pentru a determina Ccal.
Deoarece volumul este constant pentru un calorimetru bombă, nu există nici o presiune-volum de lucru. Ca rezultat:
unde ΔU este schimbarea energiei interne și qV denotă căldura absorbită sau eliberată de reacția măsurată în condiții de volum constant. (Această expresie a fost derivată anterior în secțiunea „Energie internă și entalpie”.) Astfel, căldura totală emanată de reacție este legată de schimbarea energiei interne (ΔU), nu de modificarea entalpiei (ΔH) care este măsurată în condiții de presiune constantă.
Valoarea produsă de astfel de experimente nu reflectă complet modul în care corpul nostru arde mâncarea. De exemplu, nu putem digera fibrele, astfel încât valorile obținute trebuie corectate pentru a ține cont de astfel de diferențe între valorile experimentale (totale) și reale (ceea ce poate absorbi corpul uman).
Calorimetrie la presiune constantă
Un calorimetru cu presiune constantă măsoară schimbarea entalpiei unei reacții la presiune constantă.
obiective de invatare
Discutați cum funcționează un calorimetru cu presiune constantă