Albumina serică umană (HSA) vizată cu peptida homing CAR este clonată prin înlocuirea decorinei cu ADNc HSA (Sheffield și colab., 2009) în vectorul de expresie și decorina mCAR prin înlocuirea secvenței CAR cu cea a mCAR (furnizată mai sus).
Termeni asociați:
- Neoplasm
- Proteine din sânge
- Albumină
- Anticorpi
- Proteină
- Nanoparticule
- Schimb de plasmă
- Clorura de sodiu
Descărcați în format PDF
Despre această pagină
Proteine pentru transportul hormonului tiroidian: Globulină care leagă tiroxina, transtiretina și albumina ☆
Albumină serică umană
HSA este o proteină de 66,5 kDa sintetizată de ficat. Conține 585 de aminoacizi, are un conținut ridicat de cisteină și o proporție mare de aminoacizi încărcați negativ, dar nu are carbohidrați. Cele trei domenii ale moleculei pot fi descrise într-un model ca trei mingi de tenis ambalate într-o carcasă cilindrică. Molecula matură este eliberată după scindarea peptidei semnal (18 aminoacizi) și a pro-peptidei (6 aminoacizi).
HSA se asociază cu o mare varietate de substanțe, inclusiv hormoni și medicamente care posedă o regiune hidrofobă și, prin urmare, asocierea hormonului tiroidian cu HSA poate fi privită ca fiind nespecifică. Acizii grași și ionii clorură scad legarea iodotironinei la HSA. Are patru site-uri de legare a iodotironinei.
T1/2 biologic al HSA este mai lung decât cel al TBG și TTR. HSA constituie mai mult de jumătate din conținutul total de proteine din ser și, prin urmare, este principalul factor care contribuie la menținerea presiunii osmotice coloidale. În ciuda capacității ridicate de legare a iodotironinei, afinitatea scăzută este responsabilă pentru contribuția minoră a HSA la transportul hormonilor tiroidieni. Astfel, chiar și cele mai marcate fluctuații ale concentrației HSA, inclusiv analbuminemia, nu au niciun efect semnificativ asupra nivelului hormonilor tiroidieni.
Separări și analiză
8.9.3.1.2 Albumina serică umană
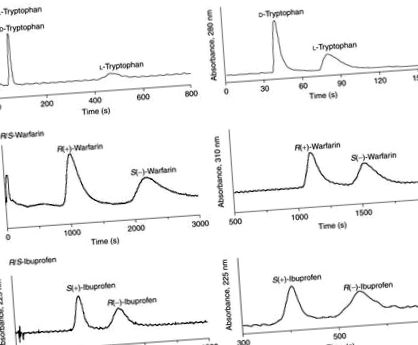
Figura 2. Enantioseparații de (a) triptofan, (b) warfarină și (c) ibuprofen pe CSP HSA preparate utilizând metodele SMCC și SIA. Condițiile LC au fost următoarele: concentrația probei, 20 μM triptofan, ibuprofen sau warfarină; volumul probei, 20 μl; fază mobilă pentru triptofan, pH 7,4, 0,067 M tampon fosfat de potasiu; faza mobilă pentru ibuprofen, pH 7,0, 0,067 M tampon fosfat de potasiu conținând 8% 2-propanol și 1 mM acid octanoic; fază mobilă pentru warfarină, pH 7,0, 0,067 M tampon fosfat de potasiu conținând 5% 2-propanol și 1 mM acid octanoic; debit pentru coloana SMCC HSA, 1,5 ml min -1 pentru triptofan, 1,0 ml min -1 pentru ibuprofen și warfarină; debitul pentru coloana SIA HSA, 0,3 ml min -1 pentru triptofan și warfarină, 0,5 ml min -1 pentru ibuprofen; dimensiunea coloanei, 5 cm × 4,6 mm ID; temperatura, 25 ° C. Reprodus cu permisiunea din Figura 6 în Mallik, R.; Wa, C.; Hage, D. S. Anal. Chem. 2007, 79, 1411–1424.
O varietate de compuși slab acizi și neutri, care includ derivați ai acidului 2-arilpropionic, cum ar fi naproxen, flurbiprofen, ibuprofen, ketoprofen și fenoprofen, folati reduși precum leucovorin și 5-metiltetrahidrofolat și benzodiazepine precum oxazepam și lorazepam sunt rezolvate pe CSP bazate pe HSA. 24 HSA sunt proteine strâns legate cu albuminele serice de la alte specii de mamifere. Caracteristicile de legare stereoselectivă ale HSA și BSA sunt foarte similare. Cu toate acestea, ordinea de eluare este inversată între CSP pe baza acestor două proteine; pe CSP bazate pe HSA, (S) -Wf eluează înainte de (R) -Wf, în timp ce pe CSP bazate pe BSA, se observă ordinea de eluție opusă. Aceste observații sunt în concordanță cu enantioselectivitatea proteinelor native. 24,26 Legarea stereoselectivă a tofisopamului, unul dintre derivații 2,3-benzodiazepinei, la om, este opusă celei din toate celelalte specii (bovine, câine, cal, porc, iepure și șobolan). Cu toate acestea, în legarea 1,4-benzodiazepinelor, albumina de câine este foarte asemănătoare cu HSA. 26
Aptasenzori
6.3.4 Diabet
Albumina serică umană glicată (GHSA) se formează prin glicarea neenzimatică a HSA prin excesul de zahăr circulant și influențează funcțiile normale HAS. Pacienții cu diabet dețin niveluri de 2-5 ori mai mari ale unui GHSA diabetic tipic în metabolismul glucozei atât a celulelor adipocitare, cât și a celulelor musculare scheletice, astfel încât implicația patogenă a formării GHSA a fost confirmată. GHSA poate fi analizat prin intermediul aptasenzorilor sensibili pe bază de grafen (Apiwat și colab., 2016). Structura buclei de ac de păr cu 23 de lungimi de nucleotide conținând agrafe de păr G-C triple și buclă de 15 nucleotide joacă un rol cheie în legarea GHSA. Aptamerele cu afinitate mare de legare au fost utilizate în combinație cu GO.
Expunerea la organofosfați
Sigeng Chen, John R. Cashman și Advances in Molecular Toxicology, 2013
3.2.3 Detectarea biomarkerului non-EC bazată pe imunoanaliză
Efectele multifuncționale ale albuminei serice umane spre neuroprotecție în boala Alzheimer
Albumina serică umană
HSA este o proteină plasmatică extracelulară multifuncțională, neglicozilată, încărcată negativ. Albumina este cea mai abundentă proteină plasmatică din plasmă (~ 60%, 40 g/L); funcția sa principală este menținerea presiunii osmotice coloidale a plasmei. În plus, HSA este o proteină extrem de versatilă, care are proprietăți multifuncționale, cum ar fi legarea ligandului și transportul, discutate mai departe (Peters, 1996; Quinlan și colab., 2005).
Albumina este, de asemenea, o componentă majoră a majorității fluidelor extracelulare, inclusiv lichidul interstițial, limfa și LCR. Deși HSA se găsește la o concentrație scăzută (∼0,2 g/L) în LCR, aceasta se ridică la ∼80% din totalul proteinei LCR (Peters, 1996). Raportul LCR la albumina serică, împreună cu alte proteine derivate din sânge din LCR, este utilizat pe scară largă în diagnosticul bolilor neurologice (Reiber, 2001).
HSA a fost implicat în AD pentru legarea sa directă și transportul Aβ, în condiții fiziologice (Biere și colab., 1996). Mai mult, albumina este un inhibitor puternic al polimerizării Aβ, reprezentând aproximativ 60% din activitatea inhibitoare a amiloidului în LCR și plasmă (Bohrmann și colab., 1999).
Dovezi suplimentare pentru implicația în patologia AD sunt că atât nivelurile serice, cât și cele ale CSF ale HSA scad odată cu îmbătrânirea (Veering și colab., 1990). Simplificată de boală, îmbătrânirea este însoțită de o scădere treptată a concentrației HSA de la aproximativ 52 g/L la 20 de ani la 38 g/L la 80 de ani (Veering și colab., 1990). Într-adevăr, rolul critic al albuminei în reglarea Aβ este susținut de studii bazate pe populație. Concentrațiile scăzute de albumină serică au fost asociate cu un risc crescut de afectare cognitivă la populația vârstnică (Llewellyn și colab., 2010). Luate împreună, dovezile prezentate susțin un rol semnificativ pentru HSA în debutul și progresia bolii AD.
Proiectare medicamente asistate de computer
4.31.2.1.2 Structura albuminei serice umane
HSA este un monomer proteic cu 585 de reziduuri care conține trei domenii elicoidale omoloage, fiecare împărțit în subdomenii A și B și dispuse pentru a forma o moleculă în formă de inimă (Figura 1). 27, 28 Conține două site-uri principale de legare a medicamentelor. 29 Situl I (sau situl warfarinei) se află pe domeniul 2 și preferă să lege compuși heterociclici mari și încărcați negativ, în timp ce situl II (sau situl indol-benzodiazepinic) este situat pe domeniul 3 și este locul preferat pentru acizii carboxilici aromatici mici . 24 Figura 1 prezintă aceste situri ocupate de liganzi reprezentativi.
Figura 1. O schemă a structurii HSA derivată din fișierul PDB, 2BXM. HSA este o moleculă în formă de inimă compusă din trei domenii omoloage care sunt colorate în magenta (domeniul 1, reziduurile 5–190), cian (domeniul 2, reziduurile 191–383) și portocaliu (domeniul 3, reziduurile 384 - capăt). Indometacina este prezentată într-o reprezentare de umplere a spațiului legată de locul I al medicamentului în domeniul 2 din partea dreaptă centrală a figurii. De asemenea, este prezentată poziția suprapusă a diazepamului (preluată din fișierul PDB, 2BXF) care se leagă în locul II al medicamentului în domeniul 3 din partea centrală stângă.
Acum există peste 40 de structuri cristaline de HSA depuse în PDB. Lucrările structurale au fost efectuate, de asemenea, utilizând rezonanța magnetică nucleară (RMN) pe domeniul 3 al HSA, 30, 31 permițând elucidarea modului de legare a moleculelor de medicament la locul II al proteinei.
Mecanisme și consecințe biologice ale oxidării și nitrației proteinelor dependente de peroxinitrit
Madia Trujillo,. Rafael Radi, în oxid nitric (ediția a doua), 2010
ALBUMIN DE SER UMAN
Pe lângă reacția directă cu peroxinitrit, HSA-SH reacționează și cu radicalii derivați din homoliza peroxinitritului, • OH (k = 3,8 × 10 10 M −1 s −1; Goldstein și Samuni, 2005), • NO2 și CO3 • - (k = 5,8 × 10 8 M −1 s −1; Goldstein și Samuni, 2005), ducând la radicali tiil și alți radicali secundari (Gatti și colab., 1994). Deși albumina tiol nu reacționează deosebit de repede cu oxidanții, poate fi totuși considerat un important eliminator intravascular datorită concentrației sale foarte mari, în special având în vedere că plasma este redusă în apărarea antioxidantă și în tiolii cu greutate moleculară mică. În acest sens, s-a constatat că izoformele oxidate ale albuminei cresc în mai multe condiții patologice (pentru o revizuire a se vedea Turell și colab., 2009). Aceste specii oxidate nu sunt prezente atunci când albumina este secretată din celulele hepatice. Astfel, pot fi considerați potențiali biomarkeri ai implicării proceselor de stres oxidativ și constituie o dovadă a conceptului de activitate de eliminare a albuminei.
Nanoparticule de proteine și peptide pentru administrarea medicamentelor
3.1 Albumină
HSA este cea mai abundentă proteină plasmatică. HSA este o proteină globulară formată din 585 de resturi de aminoacizi cu o greutate moleculară relativă de 66.500 Da (Elzoghby și colab., 2012a). Nu este o proteină standard, deoarece este extrem de robustă spre pH (stabil în intervalul de pH de 4-9), temperatură (poate fi încălzită la 60 ° C timp de până la 10 ore) și solvenți organici. Utilizarea albuminei pentru prepararea NP biodegradabile a câștigat un mare interes pentru terapeutică, în special în tratamentele împotriva cancerului. Albumina conține grupări amino și carboxilice, iar aceste grupări pot fi utilizate pentru modificări de suprafață. Mai mult, NPs bazate pe HSA au fost bine tolerate fără efecte secundare grave în studiile din studiile clinice. Ca alternativă la albumina derivată din sânge, HSA recombinantă (rHSA), o proteină modificată genetic exprimată în celulele de drojdie, a demonstrat siguranță, tolerabilitate, farmacocinetică și dinamică comparabile cu HSA nativă (Elzoghby și colab., 2012a).
Tabelul 1. Nanoparticule de albumină încărcate cu medicamente anticanceroase (cu suprafață nemodificată)