Abstract
Introducere
Homocisteina a fost sub multe speculații de la descoperirea sa în 1932. Proprietățile sale chimice au arătat o similaritate cu cisteina, de unde și denumirea de homocisteină. Încălzirea aminoacidului metionină cu acid sulfuric a dus la acest aminoacid de interes. Importanța acestei descoperiri nu poate fi subliniată fără a face aluzie la Premiul Nobel pentru chimie din 1955, acordat lui Vincent du Vigneaud „Pentru munca sa asupra compușilor de sulf importanți din punct de vedere biochimic, în special pentru prima sinteză a unui hormon polipeptidic” [1]. Ultimii ani au arătat o creștere dramatică a cercetărilor către o mai bună înțelegere a notorietății acestui aminoacid de interes (Figura 1).
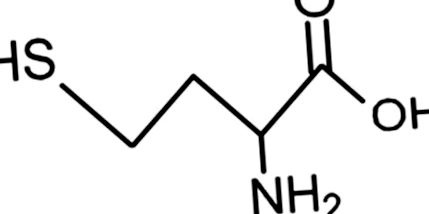
Structura homocisteinei.
În cazul deficitului de metionină, homocisteina poate fi re-metilată pentru a forma metionină [6]. Enzima N5, N10-metilenetetrahidrofolat reductază transformă homocisteina în metionină [2].
În prezența metioninei suficiente, homocisteina este utilizată în schimb pentru a produce cisteină [6]. Cistationina-β-sintaza este o enzimă (cu piridoxină (vitamina B6) ca cofactor esențial) care transformă homocisteina în cisteină [2]. Homocisteina este sintetizată din aminoacidul esențial metionină, prin urmare cisteina nu este un aminoacid esențial atâta timp cât este disponibilă suficientă metionină [6].
Baza biochimică a hiperhomocisteinemiei
În timp ce prezenta analiză va oferi o perspectivă asupra cauzei și efectului hiperhomocisteinemiei și bolilor cardiovasculare, rolul potențial al homocisteinei nutriționale este excelent, iar cititorii sunt referiți la alte articole care tratează terapii nutriționale pentru gestionarea homocisteinei.
Definiția hiperhomocisteinemiei diferă între studii [2]. Hiperhomocisteinemia este definită ca o afecțiune medicală caracterizată printr-un nivel anormal de ridicat (peste 15 μmol/L) de homocisteină în sânge [7]. Concentrația totală de homocisteină în plasmă la oamenii sănătoși (post) este scăzută și nivelul său este cuprins între 5,0 și 15,0 μmol/L atunci când se evaluează cu utilizarea HPLC sau 5,0-12,0 μmol/l când se utilizează metode de imunoanaliză [8] . Când nivelul este cuprins între 16-30 μmol/L este clasificat ca moderat, 31-100 μmol/L este considerat intermediar și o valoare peste 100 μmol/L este clasificată ca hiperhomocisteinemie severă [4]. Există două tipuri de hiperhomocisteinemie: (1) formele rare, dar severe se datorează mutațiilor genetice majore ale enzimelor implicate în metabolismul homocisteinei; (2) formele mai frecvente determină niveluri moderat ridicate de homocisteină legate de o patogenie, cum ar fi factorii genetici și de mediu [2].
A existat o indicație către o corelație semnificativă între hiperhomocisteinemie și boli cardiovasculare și complicațiile sale, cum ar fi atacurile de cord și accidentele vasculare cerebrale [8]. Se crede că hiperhomocisteinemia duce la deteriorarea celulelor endoteliale, la reducerea flexibilității vaselor și la modificarea procesului de hemostază [8]. Hiperhomocisteinemia poate duce la îmbunătățirea efectelor adverse ale factorilor de risc precum hipertensiunea arterială, fumatul, metabolismul lipidelor și lipoproteinelor, precum și la promovarea dezvoltării inflamației [8]. Prevalența hiperhomocisteinemiei poate varia semnificativ între populații și cel mai probabil depinde și de vârstă, dietă și fundal genetic [2]. Creșterea vârstei, sexul masculin, fumatul, consumul de cafea, hipertensiunea arterială, profilul lipidic nefavorabil, creatinina ridicată și alimentația defectuoasă sunt câțiva dintre factorii asociați cu creșterea nivelului de homocisteină [10]. Pe de altă parte, activitatea fizică, consumul moderat de alcool, starea bună de acid folic și vitamina B12 sunt asociate cu niveluri mai scăzute de homocisteină. Vegetarienii pot prezenta un risc mai mare de hiperhomocisteinemie din cauza nivelurilor scăzute de plasmă B12, dar diferența este probabil nesemnificativă [10].
Homocisteina și sistemul nervos
Efectul homocisteinei asupra creierului:
Până la maturitate, enzimele legate de folat implicate în sinteza purinei și pirimidinei scad aproape de zece ori. Prin urmare, acest lucru ne face să credem că furnizarea de grupări metil pentru SAM și reacțiile de metilare împreună cu reciclarea homocisteinei prin metionină sintază poate fi o funcție dominantă a metabolismului folatului creierului adult [11]. Creierul are o capacitate limitată de metabolism al homocisteinei. Folatul joacă un rol important în creier, astfel încât un mecanism crucial este în joc pentru a proteja creierul de deficitul de folat. Nivelul de 5 tetrahidrofolat din lichidul cefalorahidian este de 3 ori mai mare decât cel al plasmei și există un proces activ pentru menținerea acestuia [11]. Metionina sintază este singura enzimă din creier (țesut neural) capabilă să transforme homocisteina în metionină. Cobalamina este un cofactor (deci esențial) [11].
Țesutul cerebral utilizează trei mecanisme pentru a menține un nivel scăzut de homocisteină [11]:
Reciclare eficientă prin metionină sintază dependentă de cobalamină (având în vedere o cantitate adecvată de cobalamină și folat),
Catabolismul prin cistation beta-sintază către cistation un produs non-nociv,
Export în circulație externă [11].
În creier și în alte părți, perturbarea metabolismului homocisteinei poate rezulta din dezechilibru nutrițional, defecte genetice sau ca urmare a terapiei medicamentoase [11].
Efectul direct al homocisteinei asupra sistemului nervos:
Acțiunea homocisteinei ca neurotransmițător: homocisteina și compușii săi înrudiți pot avea un rol de agonist excitator asupra subtipului NMDA al receptorilor glutamat și dovezile recente indică, de asemenea, implicarea siturilor modulatoare ale NMDA [11]. De asemenea, s-a arătat că homocisteina, pe lângă faptul că acționează ca agonist parțial la receptorii glutamatului, acționează și ca antagonist parțial al sitului coagonist al glicinei al receptorului NMDA [11]. În prezența nivelurilor normale de glicină și a condițiilor fiziologice normale, homocisteina nu provoacă toxicitate sub concentrații milimolare. Cu toate acestea, în cazul unui traumatism cranian sau a unui accident vascular cerebral, există o creștere a nivelurilor de glicină, în care, efectul neurotoxic al homocisteinei ca agonist este mai mare decât efectul său antagonist neuroprotector. Acest lucru poate provoca leziuni neuronale prin influx de ioni de calciu sau generarea de radicali liberi [11].
Un experiment evaluativ pentru a descoperi efectul direct al homocisteinei asupra sistemului nervos central a implicat aplicarea locală a homocisteinei prin două metode diferite de administrare a medicamentului în sistemul nervos central al șobolanilor - ejecția de presiune și ionoforeza [12]. Înregistrările extracelulare au fost preluate de la neuronii cortexului cerebral, cerebelului și creierului central. Înregistrările după oricare dintre metodele de administrare au prezentat o creștere dependentă de doză a activității neuronale de către D, L-homocisteină și L-glutamat în 67% din celulele testate cu ambele medicamente. Similitudinea în doza necesară de D, L-homocisteină și L-glutamat, subliniază că D, L-homocisteina pare a fi la fel de puternică ca cea din urmă. Aceste date indică faptul că homocisteina pare să aibă o acțiune de excitare asupra neuronilor, iar această constatare poate explica simptomele neurologice asociate cu tulburări ale metabolismului aminoacizilor [12]. Unele studii sugerează, de asemenea, că nivelurile ridicate de homocisteină pot fi asociate cu modificări ale sănătății mintale, cum ar fi afectarea cognitivă, demența, depresia, Alzheimer și boala Parkinson [2, 11].
Homocisteina și bolile cardiovasculare
Bolile cardiovasculare (BCV), după cum sugerează și numele, cuprind boli ale inimii și ale vaselor de sânge [13]. Se crede că bolile cardiovasculare reprezintă o treime din totalul deceselor la nivel mondial, iar prevalența este încă în creștere [13]. BCV se numără printre bolile cu factori multipli care contribuie, ceea ce face dificilă identificarea unui anumit factor singur. Principalul factor care este relevant pentru acest studiu este homocisteina. Boala arterelor coronare este îngustarea sau blocarea arterelor și vaselor care furnizează oxigen și substanțe nutritive inimii [10]. Gravitatea bolii coronariene este clasificată ca boală a vaselor simple, a vaselor duble și a vaselor triple, folosind sistemul de notare Gensini [10]. Homocisteina a fost recunoscută ca factor de risc încă din anii 1990, pentru prezența bolilor vasculare aterosclerotice și a stărilor de hipercoagulabilitate [10]. Analizele subgrupurilor efectuate într-un studiu au arătat, de asemenea, că creșterea homocisteinei a fost asociată cu un risc mai mare de boală coronariană la pacienții cu disfuncție renală cronică [14].
Cercetătorii au dezbătut multă vreme măsura în care homocisteina ar trebui considerată un factor de risc pentru bolile cardiovasculare, deoarece, potrivit unora, doar 50% din BCV poate fi explicată prin factori de risc „clasici” și spun că riscul „nou” factorii ar putea crește semnificativ puterea predictivă CVD [2]. Dar acest lucru a fost criticat pe scară largă și există alți autori care arată că până la trei sferturi din bolile coronariene (CHD), dacă nu chiar mai multe, ar putea fi atribuite unor factori de risc „clasici” [2]. În scopul utilizării ca instrument de screening, un factor de risc ar trebui să fie asociat puternic și cauzal cu boala țintă și mulți autori se îndoiesc dacă există o astfel de relație între homocisteină și BCV [2].
Folosind 70 de participanți (70 de pacienți supuși angiografiei coronariene la Spitalul Kasturba, Universitatea Manipal) Shenov și colab. [10] a arătat că homocisteina este implicată ca promotor aterosclerotic timpuriu. Nivelul seric al homocisteinei în jeun la pacienții cu CAD (boală arterială coronariană) a fost semnificativ mai mare decât pacienții fără boală coronariană (p Figura 2
- Pitiriazis Lichenoides Chronica, rolul infecției streptococice și al azitromicinei - Vizualizare text complet
- Diferențele sexuale în aportul alimentar de-a lungul duratei de viață, cazul Libanului Nutrition Journal Full
- Înghițiți sincopa un raport de caz și o revizuire a literaturii Text complet al tulburărilor cardiovasculare BMC
- Role of Dietary Sodium in Osteoporosis Journal of the American College of Nutrition Vol 25, No sup3
- Servicii nutriționale - Prevenirea și reabilitarea bolilor cardiovasculare Medicina Michigan