Vincent Wiegmann
1 Centrul Avansat pentru Inginerie Biochimică, Departamentul de Inginerie Biochimică, University College London, Torrington Place, Londra, WC1E 7JE UK
Cristina Bernal Martinez
2 Applikon-Biotechnology BV, Heertjeslaan 2, 2629 JG Delft, Olanda
Frank Baganz
1 Centrul Avansat de Inginerie Biochimică, Departamentul de Inginerie Biochimică, University College London, Torrington Place, Londra, WC1E 7JE UK
Abstract
Obiective
Stabilirea unei metode pentru măsurarea indirectă a evaporării în sistemele de cultură celulară bazate pe microgodeuri și arătarea faptului că metoda propusă permite compensarea pierderilor de lichid în procesele alimentate în loturi.
Rezultate
S-a găsit o corelație între evaporare și concentrația de Na + (R 2 = 0,95) la utilizarea sistemului bioreactor miniatural cu 24 de godeuri (micro-Matrix) pentru o cultură discontinuă cu GS-CHO. Pe baza acestor rezultate, a fost dezvoltată o metodă de combatere a evaporării cu adăugări periodice de apă pe baza măsurătorilor concentrației de Na +. Implementarea acestei metode a dus la o reducere a pierderii relative de lichid după 15 zile de cultivare pe loturi alimentate de la 36,7 ± 6,7% fără corecții de volum la 6,9 ± 6,5% cu corecții de volum.
Concluzie
A fost stabilită o procedură pentru măsurarea indirectă a evaporării printr-o corelație cu nivelul ionilor de Na + în soluție și derivând o formulă simplă pentru a ține cont de pierderile lichide.
Introducere
Procesele biotehnologice se desfășoară în mod obișnuit la temperaturi ridicate și, ca rezultat, aerul din sistem are de obicei umiditate ridicată, ceea ce poate duce la un conținut ridicat de lichid în gazele reziduale. Pe măsură ce vaporii părăsesc sistemul prin conducta de evacuare a gazelor, volumul de umplere al vasului de cultivare va scădea treptat. Nu numai că condițiile de operare sunt direct afectate de aceste modificări de volum, evaporarea poate afecta negativ procesul prin efecte de concentrare și presiuni osmotice ridicate care duc la limitări ale creșterii celulare (Silk et al. 2010; Bareither și Pollard 2011; Lattermann și Büchs 2016 ).
Deși închiderea puțurilor reduce evaporarea, inconsecvențele ratelor de evaporare rămân o problemă pentru sistemele aerate activ, cum ar fi microbioreactoarele, în special, unde presiunile de gaz inegale duc la discrepanțe ale ratelor de evaporare (Chen și colab. 2009). În aceste sisteme, ratele de evaporare sunt guvernate de debitele de gaz, care la rândul lor pot fi afectate de condițiile de cultură. Mai ales în experimentele de cultură celulară pe termen lung, devine necesar să se compenseze lichidul evaporat prin adăugări periodice de apă distilată sterilă pentru a asigura condiții consistente pe tot parcursul experimentului. În formatele pe bază de plăci de microtitrare, evaporarea pe godeu este de obicei dedusă din pierderea totală în greutate a plăcii (Betts et al. 2014). Cu toate acestea, această metodă presupune că rata de evaporare este aceeași în toate puțurile, ceea ce poate duce la volume de lucru și condiții de cultură foarte variabile. Măsurarea efectului de concentrare a uneia sau mai multor componente media poate fi utilizată ca o alternativă viabilă, mai puțin invazivă și ușor de realizat alături de analiza eșantionului.
Această lucrare evaluează adecvarea a trei potențiali electroliți pentru utilizare ca markeri de evaporare și propune o metodă ieftină pentru a măsura indirect evaporarea în compartimente de cultură celulară la scară mică. Această nouă metodă este demonstrată ca parte a unui experiment exemplar alimentat în loturi cu celule CHO crescute în microbioreactorul micro-Matrix.
Materiale și metode
Pre-cultura
Flacoanele unei linii celulare GS-CHO care exprimă IgG (Lonza, Marea Britanie) au fost decongelate și diluate cu 49 ml de CD-CHO încălzit (Life-Technologies, Marea Britanie) conținând 25 μM MSX. Celulele au fost apoi extinse timp de 7 zile într-un balon de agitare cu capac de aerisire (250 ml volum nominal, Corning Life Sciences, SUA) montat pe un agitator orbital (Sartorius, Marea Britanie) la 37 ° C, 5% CO2 și 70% umiditate.
micro-Matrix
Micro-Matrix (Applikon-Biotechnology BV, Olanda) este o platformă de micro-bioreactoare care permite 24 de culturi paralele cu control individual al pH-ului, oxigenului dizolvat (DO) și temperaturii. Cultivările se efectuează într-o casetă cu 24 de godeuri de unică folosință, cu un volum optim de lucru între 2 și 5 ml.
procedura de cultură celulară micro-matricială
Valorile de compensare pentru calibrarea sondei de pH au fost determinate prin umplerea fiecărei godeuri a casetei micro-Matrix cu 2 mL 1 × PBS (Life-Technologies, UK) și montarea casetei pe sistemul micro-Matrix. Sondele au fost apoi lăsate pentru echilibrare, fără nici o scuturare sau adăugare suplimentară de gaze. După 1 oră, 1 ml a fost extras din fiecare godeu și măsurat pentru pH cu un pH-metru offline (Mettler Toledo, Elveția). Valorile de compensare au fost apoi ajustate astfel încât măsurătorile online să corespundă valorilor offline.
O suspensie cu o concentrație finală de 3 × 105 celule viabile ml -1 a fost preparată utilizând cantitatea adecvată de mediu CD-CHO. 3,5 ml din această suspensie au fost umplute în fiecare godeu al casetei cu godeuri pătrate de 24 de adâncimi (Applikon, Olanda). Caseta micro-Matrix a fost acoperită cu placa superioară, conectată la liniile de alimentare cu gaz și apoi fixată pe modulul termic optic (OTM) al micro-Matrix. Punctele stabilite au fost specificate la pH 7,2, 30% DO și 37 ° C. Controlul scăzut al pH-ului a fost realizat prin adăugarea de CO2; DO a fost controlat prin adăugarea de O2 și N2. Viteza de agitare a fost setată fie la 220, fie la 250 rpm. PH-ul și DO au fost măsurate ambele la intervale de 10 s folosind senzori optici amplasați în partea de jos a fiecărei godeuri. Temperatura godeului a fost controlată pentru fiecare godeu cu elemente Peltier situate, de asemenea, în partea de jos a fiecărei godeuri.
Protocol Fed-batch
Hrănirea a început în ziua a 3-a a cultivării și apoi a fost repetată la fiecare două zile. Adăugările în bolus ale Efficient Feed B (Life-Technologies, UK) au fost setate la 10% v/v din volumul inițial de lucru. În plus, suspensia celulară a fost înțepenită cu tampon de bicarbonat (250 mM Na2HCO3 și 250 mM NaH2CO3) stabilit la 2,5% v/v din volumul inițial de lucru în zilele 2, 4 și 5 pentru a ajusta pH-ul în sus în perioada de lactat ridicat. formare.
Eșantionare și analiză
Pentru cultura discontinuă, trei godeuri au fost sacrificate în fiecare zi de probă. Suspensia celulară din interiorul acestor godeuri a fost complet îndepărtată și cântărită pentru a determina pierderea de volum datorată evaporării. Toți parametrii dependenți de volum au fost corectați pentru pierderea volumului. În cazul culturii alimentate în loturi, volumele de eșantioane cuprinse între 350 și 500 μL au fost preluate din fiecare godeu la prelevare. Volumul exact depinde de analizele care se efectuează într-o anumită zi (Tabelul 1). Concentrația celulară a fost determinată utilizând Vi-CELL XR (Beckman Coulter, Marea Britanie) și suspensia celulară rămasă a fost centrifugată la 1000 × g timp de 5 minute. Analizorul FLEX Bioprofile (Nova Biomedical, SUA) a fost utilizat pentru a determina nivelurile tuturor nutrienților, metaboliților și electroliților relevanți. Cuantificarea IgG4 a fost efectuată utilizând o cromatografie lichidă (HPLC) de înaltă performanță Agilent 1200 (Agilent Technologies, Marea Britanie) cu o coloană 1 mL HiTrap Protein G HP (GE Healthcare, Marea Britanie).
tabelul 1
Tipul analizelor efectuate și volumele corespunzătoare de eșantioane ale acestora
| Numărul de celule | Vi-CELL XR | 50 | 10 |
| Nutrienți și metaboliți | FLEX bioprofil | 166 | 3 |
| Gazele și electroliții | FLEX bioprofil | 166 | 3 |
| Titlu | Agilent 1200 | 50 | 2 |
rezultate si discutii
Evaluarea diferiților markeri pentru evaporare
Experimentul inițial pe lot a evaluat concentrațiile de Na +, K + și Ca 2+ ca markeri potențiali pentru evaporare. Alegerea acestui set special de electroliți a fost determinată de capacitățile de măsurare ale bioanalizatorului disponibil. Mai mult, este esențial ca electrolitul ales să aibă un profil de concentrație care este, în general, independent de creșterea celulară și se încadrează într-un interval de concentrație adecvat pentru ca bioanalizatorul să ofere măsurători precise.
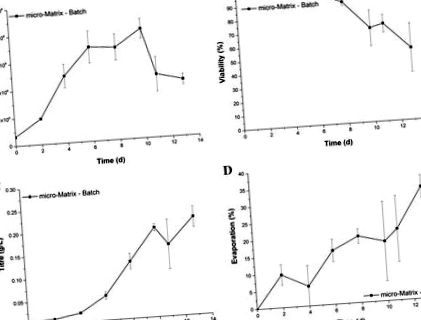
Cinetica de creștere și producție în micro-matrice prezentată în Fig. 1 respect rezultatele studiilor anterioare care folosesc linia celulară GS-CHO într-un format similar (Silk și colab. 2010) și, prin urmare, redau o cultură tipică în serie. În schimb, pierderea de lichid a depășit intervalul acceptat la începutul procesului. Cel mai înalt grad de evaporare corespunde măsurării punctului final în ziua 13 cu o pierdere de lichid de 32,9 ± 3,4%. Mai mult, barele largi de eroare indică faptul că evaporarea este supusă unui grad extins de variabilitate.
Profil de creștere (A), viabilitate (b), titru (c) și pierderea de lichid prin evaporare (d) de celule GS-CHO crescute ca cultură discontinuă în micro-matrice la o viteză de agitare de 220 rpm, un volum de lucru de 3,5 mL și control activ al temperaturii (37 ° C), DO (30%) și pH 7,2) . Barele de eroare reprezintă o abatere standard despre medie (n = 3)
Figura 2 prezintă pierderea relativă de lichid cu concentrațiile corespunzătoare de electroliți în diferite puncte de timp de-a lungul cultivării în serie. Liniaritatea corelației atât pentru K + cât și pentru Na + sugerează că concentrațiile lor rămân fie minim afectate, fie complet neafectate de creșterea celulară a acestei linii celulare specifice. Corelația dintre electrolit și evaporare este marginal mai bună pentru Na + (R 2 = 0,95) comparativ cu K + (R 2 = 0,92). O corelație este mai puțin clară (R 2 = 0,45) în cazul Ca 2+; rezultatele sunt mai împrăștiate datorită creșterii celulare care are un efect asupra concentrației de Ca 2+ sau deoarece nivelul de concentrație este prea aproape de limita inferioară a intervalului de măsurare al dispozitivului (0,1 mmol L -1). Datorită R2 ușor îmbunătățit și a nivelurilor de concentrație care se încadrează în domeniul de măsurare (40-220 mmol L -1), Na + a fost ales ca marker pentru evaporare.
Concentrația electroliților Na + (A), K + (b) și Ca 2+ (c) în funcție de evaporarea relativă (pătrat umplut), corelațiile liniare respective (linia) în timpul unei culturi discontinue cu celule GS-CHO crescute în micro-matrice. Viteza de agitare a fost setată la 220 rpm la un volum de lucru de 3,5 ml. DO a fost controlat la 30% și pH-ul la 7,2. Na +: y = 0,56 · x - 60,4, R2 = 0,95; K +: y = 6,94 · x - 55,6, R2 = 0,92; Ca 2+: 42,9 · x + 2,1, R 2 = 0,45. Barele de eroare reprezintă o abatere standard despre medie (n = 3)
Pe baza acestor constatări, se poate stabili o corelație simplă între concentrația de sodiu și evaporare (ec. 1).
unde VEvap este volumul de lichid evaporat, V0 este volumul inițial de lichid, [Na] 0 este concentrația inițială a ionilor de sodiu și [Na] t este concentrația de sodiu la momentul t.
În cazul unei culturi alimentate în loturi sau pentru a explica adăugarea altor fluide, cum ar fi acidul sau baza, concentrația dorită de sodiu în lichid trebuie corectată pe baza concentrației de sodiu din mediul de alimentare și a volumului mediului de alimentare. care se adaugă la suspensia celulară. Pentru un sistem care conține cele trei componente, mediu bazal, tampon și mediu de alimentare, evaporarea poate fi calculată folosind Eq. (2).
unde Vtotal este volumul teoretic din interiorul camerei de cultivare la momentul t.
Alegerea electroliților a fost în mare parte determinată de capacitatea de măsurare a echipamentelor disponibile. Bioanalizatorii convenționali utilizați într-un context industrial sunt adesea limitați la câțiva analiți selectați. Deși alți ioni pot furniza estimări mai precise ale pierderii de lichid, concentrarea asupra celor care sunt susținute de echipamentele utilizate în mod obișnuit oferă o abordare mai practică care poate fi implementată fără cheltuieli suplimentare.
Aplicarea compensației pentru evaporare în contextul unei culturi în loturi hrănite
Fed-batch este în prezent modul de operare preferat în procesele de producție industrială cu celule CHO (Pan și colab. 2017). Prin natură, hrănirea prelungește durata cultivării, dând naștere unei evaporări globale mai mari în comparație cu culturile convenționale în lot. Ca rezultat, metoda descrisă pentru a contracara evaporarea a fost testată în contextul unei operații alimentate în lot.
Figura 3 rezumă rezultatele a două probe alimentate în lot realizate în micro-matrice. În etapa 1 nu s-au efectuat corecții de volum, în etapa 2 procedura s-a repetat la fiecare 2 zile din ziua 5 în continuare.
Profil de creștere (A, d), viabilitate (b, e) și titru (c, f) de celule GS-CHO crescute ca cultură alimentată în lot în micro-matrice la o viteză de agitare de 280 rpm, un volum de lucru de 3 mL și control activ al temperaturii (37 ° C), DO (30%) și pH (7.2). În runda 1 (A-c) nu s-a efectuat nicio compensație pentru evaporare, în timp ce alergarea 2 (d-f) a fost supus acestei proceduri de cinci ori. Săgețile indică punctele de timp ale adăugărilor de dH2O pentru a contracara evaporarea pe baza nivelului de sodiu măsurat
Inițial, ambele culturi au progresat într-un mod similar înainte ca diferențele să devină evidente în etapele ulterioare ale procesului. Începând cu ziua 7, densitatea celulară viabilă a arătat o variabilitate mai mare pentru godeuri fără corecție de volum (CV mediu de 15,5%) comparativ cu godeurile în care lichidul evaporat a fost înlocuit în mod repetat (CV mediu de 9,5%). Densitățile celulare viabile de vârf au fost între 12,01 × 106 și 14,86 × 106 celule ml -1 pentru godeuri cu corecție de volum și 11,75 × 106 - 15,47 × 106 celule ml -1 când pierderea de lichid nu a fost contracarată. În mod corespunzător, cinetica de producție a arătat o creștere similară a spread-ului cu titruri finale variind de la 0,62 la 0,71 g L -1 cu corecții de volum și de la 0,53 până la 0,89 g L -1 fără corecții de volum. Mai mult, fără compensarea pierderii de lichid, viabilitatea celulei a scăzut prematur în majoritatea godeurilor.
Figura 4 rezumă pierderea de lichid și osmolalitatea din fiecare godeu la sfârșitul ambelor curse. Prin corecțiile repetate de volum, pierderea de lichid ar putea fi redusă substanțial de la 36,7 ± 6,7 la 6,9 ± 6,5% Într-un caz (godeul B1), pierderea de lichid a fost ușor supracompensată, rezultând o valoare negativă. Ca o consecință a evaporării excesive, osmolalitățile finale ale culturilor au diferit substanțial în ambele condiții. Fără corecții de volum s-au observat valori medii de 273,8 ± 13,1 mOsmol, în timp ce o medie de 430,4 ± 31,2 mOsmol a fost atinsă fără adăugări de apă.
Valorile finale ale pierderii relative de lichid (A) și osmolalitate (b) după 15 zile de două culturi alimentate pe loturi cu celule GS-CHO crescute în micro-matrice. În etapa 1 nu s-a efectuat nicio compensație pentru evaporare, în timp ce etapa 2 a fost supusă acestei proceduri de cinci ori. Viteza de agitare pentru ambele curse a fost setată la 280 rpm, volumul de lucru a fost de 3 ml, temperatura a fost controlată la 37 ° C, DO la 30% și pH-ul la 7,2
Concluzie
Concentrația ionilor Na + poate fi utilizată ca marker pentru evaporare în aplicații de cultură celulară cu GS-CHO. Folosind concentrația de ioni Na + pentru a măsura indirect pierderea de lichid, pierderea relativă de lichid după 15 zile de cultivare pe loturi alimentate a fost redusă cu aproximativ 30% comparativ cu culturile fără corecții de volum. S-a demonstrat că pierderea de lichid crește osmolalitatea finală cu aproape 60%. Deși cinetica creșterii a urmat o tendință similară, lipsa corecției volumului a dus la o variabilitate crescută (CV> 15%) și la un debut mai timpuriu al morții celulare. Atât variabilitatea crescută, cât și schimbarea mediului de cultură din puțuri fără corecții de volum pe parcursul cultivării fac argumente convingătoare pentru punerea în aplicare a metodei descrise.
Deoarece mulți dintre bioanalizatorii obișnuiți sunt capabili să măsoare concentrația de sodiu, nu sunt necesare cheltuieli suplimentare pentru implementarea acestei proceduri. În plus, pot fi folosiți alți electroliți pentru a deduce evaporarea în cazul în care măsurătorile de ioni Na + sunt impracticabile.
Mulțumiri
Această lucrare a fost susținută de Centrul de Formare în Doctorat Industrial (IDTC) al Consiliului de Inginerie și Științe Fizice din Marea Britanie (EPSTC) în conducerea ingineriei bioproceselor (EP/G034656/1). VW dorește, de asemenea, să mulțumească Applikon Biotechnology pentru sprijinul financiar suplimentar acordat studenței sale la EngD.
Respectarea standardelor etice
Conflict de interese
Autorii declară că nu au niciun conflict de interese.
- O metodă de urmărire pentru a determina rate de uzură extrem de scăzute ale polietilenei cu greutate moleculară foarte mare
- O metodă simplă pentru inhibarea coroziunii oțelului carbon de sare de azotat topită pentru
- Anemie Simptome Semne ale numărului scăzut de celule roșii din sânge
- Studiul celulelor cancerului de sân aruncă o nouă lumină asupra homeopatiei - asistență medicală primară holistică
- 10 actori care au murit aproape din cauza acțiunii intense a metodei