Mohammad Rezaee
Grup în științe radiaționale, Departamentul de Medicină Nucleară și Radiobiologie, Facultatea de Medicină și Științe ale Sănătății, Universitatea Sherbrooke, Sherbrooke, QC, Canada J1H5N4
Elahe Alizadeh
Grup în științe radiaționale, Departamentul de Medicină Nucleară și Radiobiologie, Facultatea de Medicină și Științe ale Sănătății, Universitatea Sherbrooke, Sherbrooke, QC, Canada J1H5N4
Darel Hunting
Grup în științe radiaționale, Departamentul de Medicină Nucleară și Radiobiologie, Facultatea de Medicină și Științe ale Sănătății, Universitatea Sherbrooke, Sherbrooke, QC, Canada J1H5N4
Léon Sanche
Grup în științe radiaționale, Departamentul de Medicină Nucleară și Radiobiologie, Facultatea de Medicină și Științe ale Sănătății, Universitatea Sherbrooke, Sherbrooke, QC, Canada J1H5N4
Abstract
1. Introducere
10 nm) de LEE în materie biologică, astfel de studii trebuie efectuate pe pelicule ADN foarte subțiri de grosime similară. Filmele subțiri Pt-ADN ar putea oferi o abordare experimentală pentru a investiga efectele directe ale electronilor secundari și ale altor particule cu rază scurtă de acțiune (sau specii secundare) asupra ADN-ului în prezența compușilor Pt. Astfel de investigații ar putea dezvălui mecanisme care stau la baza efectului sinergic dintre radiații și medicament, care pot avea implicații pentru optimizarea protocoalelor în CRT, precum și în proiectarea și dezvoltarea de noi medicamente chimioterapeutice și radiosensibilizante [14].
Compușii Pt precum cisplatina și carboplatina se leagă de atomul N7 al bazelor purinice și produc aducti Pt-ADN incluzând în principal legături încrucișate intrastrand, legături încrucișate interstrand și legare monofuncțională la guanină [24]. Aductii distorsionează conformația ADN și reduc stabilitatea structurală a ADN-ului [24, 25]. Mai mult, ADN-ul trebuie să tolereze condițiile de incubație necesare pentru a reacționa cu compușii Pt. În majoritatea studiilor in vitro, o soluție de ADN este amestecată cu o soluție de compuși Pt la 37 ° C timp de 24 sau 48 de ore [26-30]. Aceste condiții afectează integritatea ADN-ului ca urmare a proceselor de depurinare și oxidare [31]. Pentru a maximiza cantitatea de compuși Pt legați de ADN păstrând ADN-ul intact, toți parametrii implicați în prepararea filmelor trebuie cunoscuți și controlați cu atenție. În special, trebuie determinate condițiile experimentale pentru reacția compușilor Pt cu ADN, precum și efectul legării chimice a compușilor Pt asupra stabilității ADN-ului.
În studiul de față, investigăm parametrii compușilor Pt și reacțiile de platinare asupra integrității ADN-ului în prepararea filmelor de cisplatină/ADN și carboplatină/ADN. Condițiile experimentale optime sunt determinate să păstreze o proporție ridicată a formei supraînfășurate de ADN plasmidic în filmele Pt-ADN.
2. Secțiunea experimentală
2.1. Prepararea ADN-ului plasmidic
ADN-ul plasmidic (pGEM-3Zf (-), 3197 perechi de baze, aproximativ 1968966 amu per plasmidă) a fost extras din Escherichia coli JM109 și purificat cu un kit de plasmidă HiSpeed Maxi (QIAGEN) [32]. ADN-ul plasmidic purificat a constat din 96% forme supraînfășurate, 2% cancatemeric și 2% forme circulare tăiate. Concentrația de ADN și cantitatea relativă de proteine din soluția de ADN plasmidic a fost apoi calculată prin măsurarea raportului de absorbție ultravioletă (UV) a ADN-ului și a proteinelor la 260 nm și, respectiv, 280 nm, cu un spectrofotometru Synergy HT-I. Raportul a fost de 1,98, ceea ce corespunde unei purități mai mari de 85% [33]. Tamponul TE (Tris-EDTA: 10 mM - 1 mM) a fost separat de ADN prin filtrare pe gel cu un mediu Sephadex G-50 [34]. Astfel, soluția finală a constat din ADN și ddH2O după filtrare. Pentru a evalua efectul Tris asupra legării compușilor Pt de ADN, au fost pregătite două grupuri diferite de soluții de ADN. În primul grup, tamponul Tris a fost adăugat la soluția de ADN la raportul unei molecule de tris pe nucleotidă, iar în al doilea grup, soluția de ADN a fost preparată numai cu ddH2O. Concentrația ADN a fost aceeași în ambele grupuri. În fiecare grup, probele de control au fost păstrate la temperatura de -20 ° C și cuantificate pentru analiza efectului temperaturii asupra ADN-ului.
2.2. Platinarea ADN-ului plasmidic
2.3. Analiza legării ADN-platină
Concentrația de platină în soluții a fost măsurată prin spectroscopie de masă plasmatică cuplată inductiv Elan DRC II (ICPMS, de la Perkin Elmer) care a fost utilizată ca metodă adecvată pentru măsurarea platinei în multe aplicații biomedicale [37, 38]. În plus, trei probe martor constând din compuși Pt dizolvați în ddH2O la concentrații cunoscute au fost, de asemenea, pregătite pentru calibrarea măsurătorilor ICPMS ale probelor Pt-ADN. Concentrația ADN a fost măsurată prin spectrofotometrie. S-a determinat din densitatea optică a ADN-ului în soluție măsurată prin absorbția UV la o lungime de undă de 260 nm. Concentrația de ADN a fost calculată din densitatea optică de referință.
2.4. Prepararea filmelor de substrat, ADN și Pt-ADN
2.5. Cuantificarea ADN și a filmelor Pt-ADN
2.6. Analize statistice
Software-ul OriginPro 8.1 SR1 (OriginLab Corporation) a fost utilizat pentru analize statistice și matematice. Testul t asociat a fost testul statistic în care o probabilitate de 0,05 (5%) a fost considerată semnificativă.
3. Rezultate si discutii
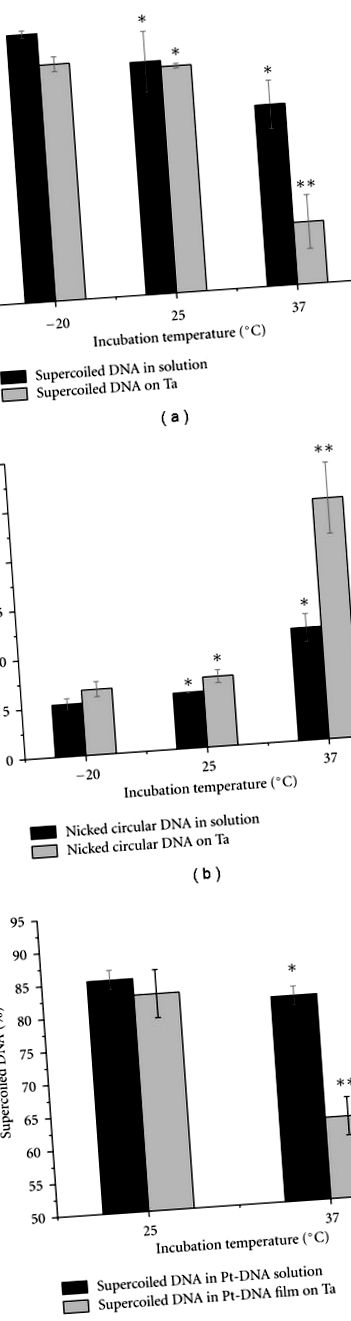
3.1. Efectele temperaturii de incubație asupra probelor de ADN și Pt-ADN
3.2. Cinetica compușilor Pt de legare la ADN
Cinetica legării compușilor Pt la ADN-ul plasmidic. Compușii Pt sunt: (a) cisplatină cu rapoartele inițiale în soluția de 20: 1, (b) 200: 1 și (c) carboplatină cu rapoartele inițiale de 40: 1 și (d) 200: 1. curbele arată cantitatea de compuși Pt legați per moleculă de ADN la timpi de incubație diferiți la 25 ° C. Datele din (a) - (d) sunt mijloace din trei măsurători; barele de eroare prezintă abateri standard. Liniile negre continue se potrivesc exponențial cu datele.
Deoarece compușii Pt pot reacționa cu majoritatea tampoanelor [42], concentrația lor este, de asemenea, un parametru relevant în procesul de platinare a ADN-ului (adică, tampoanele concurează cu ADN pentru legarea compușilor Pt). Tris este utilizat pe scară largă ca tampon, în special pentru soluții de acizi nucleici. De asemenea, reacționează cu compușii Pt pentru a produce cis- [Pt (NH3) 2 (N-Tris) (OH)] + și cis- [Pt (NH3) 2 (N, O-TrisH - 1)] + [43]. Graficele cu bare din Figura 3 prezintă o comparație a compușilor Pt legați la raporturile ADN pentru trei timpi de incubație diferiți la 25 ° C pentru două soluții diferite: (i) un amestec de ADN, cisplatină și ddH2O și (ii) un amestec de ADN, cisplatină, ddH2O și tris cu raportul de concentrație de 1: 1 nucleotidă. Raportul de concentrație inițială dintre cisplatină și ADN a fost de 20: 1 în soluții. Rezultatele demonstrează că raportul dintre cisplatina legată și ADN este mai mult decât dublu atunci când reacția de platinare are loc într-o soluție ddH2O fără molecule tris.
Impactul tris asupra reacției de platinație a ADN-ului. Rapoartele Pt-ADN în soluțiile de cisplatină-ADN incubate timp de 45, 90 și 180 de minute la 25 ° C sunt comparate în prezența și absența tris. Datele sunt mijloace din trei măsurători; barele de eroare prezintă abateri standard.
3.3. Efectele timpului de incubație asupra ADN și a filmelor Pt-ADN
Graficele cu bare din Figura 4 arată o comparație a procentului de probe de ADN supraînfășurat și Pt-ADN care au fost incubate la 25 ° C timp de 2, 4 și 8 ore. Analizele au fost efectuate pentru probe care au fost recuperate (i) din soluție, imediat după incubare (Figura 4 (a)) și (ii) din filmele depuse pe Ta (Figura 4 (b)). Probele de ADN-Pt au fost preparate fie cu cisplatină, fie cu carboplatină. Raportul de concentrație inițial al compușilor Pt față de ADN a fost de 200: 1 și cel al tamponului TE a fost de trei ioni organici pe nucleotidă. După cum se vede din Figura 4, mai mult de 90 la sută din ADN, în probe incubate timp de 2 ore, se află în formă supraînfășurată. Proporția formei supraînfășurate scade atunci când probele sunt incubate timp de 4 ore sau mai mult. Scăderea este semnificativă statistic în toate probele, cu excepția probei de soluție de ADN pur. După cum s-ar putea aștepta, scăderea este mai mare în filmele Pt-ADN decât în probele de ADN. Astfel, este posibil să se pregătească filme Pt-ADN cu o proporție mare de ADN supraînfășurat la diferite rapoarte de Pt legat la ADN, prin amestecarea ADN-ului cu concentrații mari de soluție de compus Pt și restricționarea lungimii incubației la mai puțin de 2 ore, atâta timp cât temperatura de incubație nu depășește 25 ° C.
Comparația procentelor de forme supraîncărcate în probe de ADN, cisplatină-ADN și carboplatină-ADN (a) în soluție și (b) pe substrat Ta, după incubare timp de 2, 4 și 8 ore la 25 ° C. Datele sunt mijloace din trei măsurători; barele de eroare prezintă abateri standard. * indică valoarea P> 0,05, ** indică valoarea P Figura 5 (a) arată migrația diferitelor forme de cisplatină-ADN în gelul de electroforeză. Mobilitatea benzilor circulare, cancatemerice și superînfășurate este modificată odată cu creșterea numărului de molecule Pt legate pe nucleotidă (Rb). Schimbarea se datorează distorsionării diferitelor forme de ADN de către cisplatină, deoarece se știe că legăturile încrucișate Pt-ADN provoacă modificări conformaționale în ADN, inclusiv scurtarea (îndoirea) și desfacerea [44, 45]. Distorsiunea devine mai mare în funcție de cantitatea de molecule Pt legate. Figura 5 arată dependența mobilității formelor circulare supercirculate, tăiate și cancatemerice ale probelor de cisplatină-ADN în funcție de raportul Rb într-un gel de agaroză de 1%. Mobilitatea fiecărei forme de Pt-ADN este normalizată la aceeași formă a unei probe de ADN nemodificat (Figura 5 (b)). După cum se vede din Figura 5 (b), migrația configurațiilor circulare și superînfășurate creste în general odată cu creșterea Rb. Cu toate acestea, mobilitatea formei circulare tăiate crește cu o rată mai rapidă decât cea a formei supraînfășurate. Mobilitatea configurației cancatemerice scade odată cu creșterea în Rb până la 0,009 și apoi crește pentru Rb mai mare.
Mobilitatea moleculelor de cisplatină-ADN în gelul de agaroză. (a) Migrația diferitelor configurații ale moleculelor de cisplatină-ADN separate prin electroforeză. Banda 1 este pentru o probă de ADN și benzile 2-5 sunt pentru eșantioane de cisplatină-ADN cu numărul de molecule de cisplatină legate per nucleotidă, Rb, de 0,0057, 0,008, 0,0091 și respectiv 0,0219. (b) Mobilitatea normalizată a formelor circulare, superînfășurate și cancatemerice a probelor de ADN Pt la diferite Rb în electroforeză pe gel.
Deoarece numărul de molecule Pt per plasmidă reprezintă probabil o distribuție Poisson pentru fiecare raport Pt-ADN, acest lucru ar fi de așteptat să reducă rezoluția gelurilor de agaroză prin creșterea dispersiei în fiecare bandă (adică lățimea benzii). Banda plasmidică liniară se află între benzile circulare tăiate și cancatemerice; astfel, o creștere a lățimii benzii ar putea împiedica cuantificarea precisă a benzii liniare, care este de obicei mai slabă decât celelalte. Mai mult decât atât, benzile circulare tăiate și cancatemerice se îmbină datorită lățimii crescute a benzii și formează o bandă la Rb = 0,022. Rezultatele noastre arată că schimbările de mobilitate sunt substanțiale pentru Rb mai mare de 0,005.
4. Concluzie
Prin înregistrarea cineticii legării compușilor Pt de ADN, este posibil să se extrapoleze diferite rapoarte Pt-ADN din curbele cinetice. Am constatat că proporția de ADN supraînfășurat este mai mare de 90% în filmul Pt-ADN când reacția de platinare a ADN-ului este efectuată la 25 ° C timp de mai puțin de 2 ore în soluții care conțin compusul Pt cu cantități mai mici de 3 × 10 −2 molecule Pt pe nucleotidă și concentrația minimă de tampon Tris (o moleculă tris pe nucleotidă). În aceste condiții, electroforeza pe gel de agaroză este o metodă precisă pentru cuantificarea deteriorării ADN-ului. De asemenea, am stabilit că numărul maxim de compus Pt legat per nucleotidă este de aproximativ 5 × 10 −3 în condițiile noastre optime. Acest raport este cu un ordin de mărime mai mare decât cele găsite în studiile biologice și aplicațiile clinice [46]. Aceste rapoarte ridicate, totuși, sunt utile pentru studii mecanice in vitro în care sunt necesare cantități substanțiale de produs. Prin urmare, am constatat că prin ajustarea concentrației inițiale a compușilor Pt în soluție, se pot obține filme Pt-ADN având un raport controlat cunoscut de agenți chimioterapeutici de platină la ADN, menținând în același timp integritatea ADN-ului.
Mulțumiri
Sprijinul financiar pentru această activitate a fost oferit de Institutul canadian de cercetare în sănătate (ICIR) și de programul internațional de bursă de intrare Marie Curie. Autorii doresc să-i mulțumească Dr. Domnul Andrew D. Bass, dl. Pierre Cloutier și dna. Sonia Girouard pentru comentarii și sugestii utile.
- Te poți gândi subțire de ce mintea ta contează pentru pierderea în greutate
- Indicele glicemic (GI) și încărcarea glicemică (GL) pentru pâine crocantă de secară, Media a 4 studii
- Electroterapie Cum funcționează programul nostru de slăbire; Terapia subțire
- Tratamente de terapie Carbossi - Group Medical Contouring Bodyon
- Terapia diuretică - o prezentare generală Subiecte ScienceDirect