Abstract
fundal
Dieta neonatală are un impact asupra multor sisteme fiziologice și poate modifica riscul de a dezvolta boli metabolice și obezitate mai târziu în viață. Mai puțin bine studiat este efectul dietei postnatale (de exemplu, compararea hranei cu lapte uman (HM) sau formula cu lapte (MF)) asupra bioenergeticii mitocondriale. Astfel de efecte pot fi cele mai profunde în țesuturile splanchnice care ar avea o expunere timpurie la factori asociați dietei sau derivați de microbi intestinali.
Metode
Pentru a aborda această întrebare, am măsurat fenotipurile bioenergetice mitocondriale ileale și hepatice la purceii masculi hrăniți cu HM sau MF din vârsta de 2 zile până la 21 de ani. Țesutul ileal și hepatic au fost prelucrate pentru respirația mitocondrială (numai substrat [piruvat, malat, glutamat], substrat + ADP și „scurgere” de protoni post-oligomicină; măsurat prin metode Oroboros), ADN mitocondrial (ADNmt) și expresie genetică relevantă analize.
Rezultate
Nu s-au observat diferențe între grupurile de dietă în indicii bioenergetici mitocondriali în țesutul ileal. În contrast, ficatul dependent de ADP, capacitatea OXPHOS legată de complexul I și complexul OXPHOS legat de complexul I + II au fost semnificativ mai mari la animalele MF comparativ cu purceii hrăniți cu HM. Interesant este faptul că abundențele de transcripție p53, Trap1 și Pparβ au fost mai mari la hrana MF în raport cu purceii hrăniți HM din ficat. Numerele de copii ale ADN-ului mitocondrial (normalizate la ADN-ul nuclear) au fost similare în interiorul țesutului, indiferent de dieta postnatală și au fost
De 2-3 ori mai mare la ficat vs. țesut ileal.
Concluzie
În timp ce mecanismele rămân a fi identificate, datele indică faptul că dieta neonatală poate avea un impact semnificativ asupra fenotipurilor bioenergetice mitocondriale hepatice, chiar și în absența unei modificări a abundenței ADNmt. Deoarece respirația mitocondrială hepatică permeabilizată a fost crescută la purceii MF numai în prezența ADP, sugerează că hrana cu formulă a dus la o rotație mai mare a ATP. Mecanismele și semnalele specifice implicate în diferențele legate de dieta neonatală în bioenergetica hepatică rămân a fi elucidate.
fundal
S-a demonstrat că alăptarea are un impact pozitiv asupra sistemelor fiziologice ale corpului, inclusiv a sistemului imunitar și a țesuturilor importante din punct de vedere metabolic, cum ar fi ficatul, adiposul și centrele cognitive din creier [1, 2]. Studii recente au raportat că sugarii hrăniți cu lapte cu formula (MF) prezintă o creștere mai rapidă în greutate în primele săptămâni de viață comparativ cu sugarii alăptați, iar acest lucru pare a fi asociat cu creșterea în greutate mai târziu în viață [3,4,5]. Compoziția nutritivă a laptelui uman (HM) în comparație cu formulele de lapte poate juca un rol semnificativ în rezultatele metabolice observate și în diferențele de sănătate raportate atunci când se compară aceste două diete neonatale [6,7,8,9,10,11]. Funcția mitocondrială și homeostazia energetică afectează toate aceste sisteme, dar rolul dietei sugarului și programarea bioenergeticii celulare rămâne în mare parte neexplorat.
Există o apreciere din ce în ce mai mare pentru impactul dietei timpurii asupra „programării” sistemelor fiziologice cu potențiale consecințe metabolice în copilărie sau la maturitate. Mai important, există un consens din ce în ce mai mare că „efectele de programare” nutriționale persistă și influențează riscul de alergii, astm, obezitate, diabet și boli cardiovasculare mai târziu în viață [1, 19,20,21,22,23,24]. Am emis ipoteza că dieta neonatală (HM și MF) ar afecta diferențial respirația mitocondrială în intestinul subțire (ileon) și ficat. Pentru a aborda ipoteza noastră, am folosit purcei hrăniți cu HM și MF în condiții experimentale controlate, datorită variabilității inerente asociate cu purceii hrăniți cu scroafă (de exemplu, adăpostirea fermei, contactul cu pielea mamei și dieta de alăptare). Țesuturile au fost colectate de la purcei hrăniți cu HM și MF în perioada 2-21 postnatală, pentru a determina respirația condusă de substrat și ADP, precum și numărul de copii ale ADN-ului mitocondrial. Din câte știm, acesta este primul studiu care caracterizează impactul paradigmelor de hrănire postnatală asupra funcției mitocondriale tisulare într-un model animal mai mare.
Metode
Design de studiu
Prelucrarea țesuturilor pentru analiza funcțională mitocondrială
Animalele au fost postite timp de 8 ore înainte de colectarea țesutului. Un subset de purcei a fost ales aleatoriu pentru a evalua funcția mitocondrială (HM, n = 8-11; MF, n = 8-11; vezi cifrele individuale). Am măsurat 50 cm de la capătul distal al intestinului subțire, iar la acel punct țesutul a fost tăiat ca o probă proximală de 15 cm. Probele de ileal și ficat pentru analiza funcției mitocondriale au fost prelucrate imediat după recoltare. O porție de ileon și ficat (~ 40 mg) a fost imediat scufundată în tampon de conservare rece ca gheața (BIOPS) conținând 10 mM tampon Ca-EGTA, 20 mM imidazol, 20 mM taurină, 50 mM K-MES, 0,5 mM ditiotreitol, 6,56 mM MgCl2, 5,77 mM ATP și 15 mM creatină fosfat (pH de 7,1) [26], pentru analiza respirației mitocondriale în decurs de 1-2 ore de la colectarea țesuturilor.
Probele de ileal și ficat au fost tocate (0,1-0,2 mm) folosind o pensetă mică și ascuțită în timp ce erau pe gheață și permeabilizate chimic timp de 20 de minute în tampon BIOPS conținând 50 μg/ml saponină la 4 ° C [27,28,29,30]. Probele au fost transferate în 2 ml de tampon MIR05 (0,5 mM EGTA, 3 mM MgCl2, 60 mM K-lactobionat, 20 mM taurină, 10 mM KH2PO4, 20 mM HEPES și 110 mM zaharoză și 1 mg/ml acid gras esențial- albumină serică de bovine liberă (Sigma Aldrich, St. Louis, MO, SUA; Lot SLBF5061V) urmată de 10 minute de amestecare pe un agitator pentru a spăla saponina rămasă. Mai puțin de 10 mg ileon cu greutate umedă și aproximativ 3 mg de ficat cu greutate umedă au fost transferate într-o cameră respirometră Oxygraph-2 k (O2k) (Oroboros Instruments, Innsbruck, Austria) conținând 2 ml de tampon MIR05 [28, 31, 32].
Respirometrie de înaltă rezoluție (HRR)
Înainte de fiecare experiment, s-a efectuat o calibrare a fundalului pe fiecare senzor de oxigen poligrafic O2k (POS). Această calibrare a fost efectuată în tampon MIR05 la saturație de aer. Zero de oxigen și calibrări instrumentale de fond au fost efectuate la intervale regulate pe parcursul perioadei de colectare a datelor ((12 luni) folosind titrări de ditionit. Acest lucru a asigurat fundalul instrumental POS acceptabil și stabilitatea în timp [26]. Temperatura a fost menținută la 37 ± 0,01 ° C de către un Peltier electronic în timpul tuturor experimentelor de respirometrie de înaltă rezoluție (HRR). Concentrația de O2 în tamponul MIR05 a fost înregistrată la intervale de 2 până la 4 s din care fluxurile de O2 au fost calculate în intervalul picomolar (DatLab versiunea 6; Oroboros Instruments, Innsbruck, Austria) [31]. Odată ce probele de țesut au fost plasate în camerele O2k, a fost creată o fază gazoasă. Aproximativ 1 ml de 99% O2 a fost injectat în fiecare cameră O2k și echilibrarea fazei gazoase și a concentrațiilor de MIR05 O2 a fost monitorizată până când s-a obținut o concentrație de O2 de ± 400 μM în tamponul MIR05; Măsurătorile fluxului de O2 au fost de obicei făcute atunci când concentrațiile de O2 au fost în intervalul 200-400 μM pentru a minimiza orice artefacte de dependență de O2 și pentru a evita limitările potențiale ale difuziei de oxigen în probele de țesut permeabilizat.
Numărul copiei ADN-ului mitocondrial
ADN-ul a fost extras din
25 mg de țesut ileal înghețat folosind QIAamp Fast DNA Tissue Kit (QIAGEN, Germantown, MD) conform protocolului producătorului. Aproximativ 500 mg de ficat au fost omogenizate în PBS (Gibco, Thermo Fisher). ADN-ul a fost extras din echivalentul
25 mg de ficat folosind QIAamp Fast DNA Tissue Kit. Standardele ADN pentru fiecare țintă au fost generate folosind primerii enumerați în tabelul 2 pentru a amplifica genele mitocondriale ND1 (519 perechi de baze (bp) amplicon) și Cox1 (477 bp amplicon), precum și gena nucleară β-actină (496 bp amplicon) utilizând GoTaq Green Master Mix (Promega, Madison, WI). Produsele PCR au fost separate pe un gel de agaroză 1% și benzile de amplicon au fost excizate și extrase folosind QIAquick Gel Extraction Kit (QIAGEN, Germantown, MD). Concentrațiile au fost determinate folosind un spectrofotometru NanoDrop 1000 (NanoDrop, Wilmington, DE) și un fluorometru Qubit 2.0 utilizând kitul de testare dsDNA HS (Invitrogen). Numărul de copii per μl de ADN a fost determinat folosind ecuația:
număr de copii/μl = (cantitate (ng/μl) * 6,022 × 10 23 număr/mol)/(lungime (bp) * 1 × 10 9 ng/g * 650 g/mol de bp).
Standardele au fost diluate în serie de 10 ori de la 1 X 10 8 copii/μl la 1 X 10 3 copii/μl pentru a construi o curbă standard în 6 puncte. Pentru PCR în timp real, noii primeri localizați în amplicon pentru ND1, Cox1 și β-actină (Tabelul 2) au fost proiectați utilizând Instrumentul PrimerQuest al Integrated DNA Technology (IDT) (www.idtdna.com/Primerquest/Home/Index). ADN (200 pg) a fost utilizat într-o reacție de 10 μl PCR folosind Fast SYBR Green Master Mix (Applied Biosystems) pe un sistem ViiA 7 Real-Time PCR (Applied Biosystems). Numărul de copii ADNmt a fost calculat utilizând curbe standard și normalizat folosind abundența genei nucleare β-actină. Toate probele de purcei disponibile au fost utilizate pentru a determina numărul de copii ale ADN-ului mitocondrial (HM, n = 11; MF, n = 11 pe țesut).
Expresia genelor
ARN a fost extras din
30 mg de țesut ileon înghețat folosind RNeasy Plus Mini Kit (Qiagen) conform protocolului producătorului. Pentru ARN hepatic,
100 mg de ficat congelat au fost omogenizați folosind miRNeasy Mini Kit (Qiagen) și omogenizat echivalent cu
Pentru extracția ARN s-au utilizat 30 mg de ficat din fiecare probă. Concentrația a fost determinată utilizând absorbția UV. Un μg de ARN total a fost folosit pentru a crea ADNc utilizând kitul de sinteză iScript cDNA (Bio-Rad, Hercules, CA) conform protocolului producătorului. ADNc a fost diluat și 10 ng de ADNc au fost utilizate într-o reacție PCR folosind Fast SYBR Green Master Mix (Applied Biosystems) pe un sistem ViiA 7 Real-Time PCR (Applied Biosystems). O curbă standard a fost generată prin punerea în comun a ADNc nediluat de la diferite tratamente pentru a crea un pool principal. Amestecul master ADNc a fost diluat în serie de 5 ori în total de patru ori, pentru o curbă standard arbitrară de cinci puncte. Expresia ARN a fost normalizată pentru ileon folosind media geometrică a trei ARN-uri de referință (Rps16, Rpl27 și 18S) și pentru ficat folosind media geometrică a două ARN-uri de referință (Rps16 și 18S) care nu au fost modificate prin tratament. Toate probele de purcei disponibile au fost utilizate pentru a determina expresia genei mitocondriale (HM, n = 11; MF, n = 11). O probă de ficat de purcei hrănită cu MF a fost îndepărtată din cauza calității slabe a ARN-ului (RIN
6.5). Grundurile au fost proiectate folosind PrimerQuest IDT și sunt listate în Tabelul 3.
Analize statistice
Toate datele sunt prezentate ca mijloace ± SEM. Datele au fost analizate prin testul t cu două cozi și p
Rezultate
Fenotipuri de respirație mitocondrială
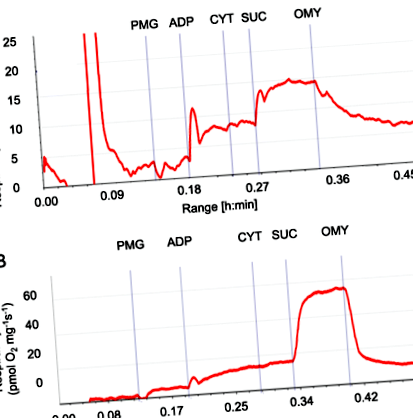
O figură a fluxului de oxigen folosind ileon permeabilizat și probe de ficat derivate dintr-un purcel de 21 de zile hrănit cu HM este prezentat în Fig. 1. Acest protocol oferă evaluarea „scurgerilor respiratorii” (L) susținut în principal de fluxul de electroni prin complexul I al lanțului respirator după adăugarea de piruvat, malat și glutamat (PMG-L). Protocolul oferă, de asemenea, capacitatea OXPHOS (P) după adăugarea ADP în urma piruvatului, malatului și glutamatului (PMG-P); P reprezintă capacitatea maximă de OXPHOS legată de ADP legată de complexul I prin calea N, transferul de electroni are loc prin complexul I. Ulterior, se adaugă succinat (SUC) pentru a induce respirația legată de complexul II. Am determinat contribuția fluxului de electroni din respirația complexă I și II, reprezentând capacitatea maximă de OXPHOS legată de ADP care a fost măsurată în ileon. Apoi, OMY a fost adăugat pentru a evalua respirația scurgerilor atunci când s-au furnizat substraturi și ADP, dar ATP sintază a fost inhibată, măsurând scurgerea de protoni din complexele I și II.
Fluxuri respiratorii ilustrative ale țesutului ileon permeabilizat de la purcei în vârstă de 21 de zile. A ileon și b eșantionul de ficat urme originale din oxograful Oroboros arată răspunsuri la protocolul de titrare a substratului-inhibitor, așa cum este descris în secțiunea de rezultate
Am evaluat impactul dietelor neonatale asupra respirației mitocondriale în ileonul permeabilizat în ziua 21 (Fig. 2a). Nu s-au observat diferențe semnificative în explanții de ileon permeabilizat pentru toți parametrii testați: scurgere respiratorie PMG, capacitate OXPHOS legată de complexul I măsurată după adăugarea ADP, capacitate OXPHOS legată de complexul I și II (CI + II) P) măsurată după adăugarea de succinat (SUC) și a scurgerilor legate de complexul I și II (OMY). În ficat (Fig. 2b), capacitatea OXPHOS legată de Complex I mai mare și capacitatea OXPHOS legată de Complex I și II mai mare au fost observate la purceii hrăniți cu MF comparativ cu purceii hrăniți cu HM.
ADN mitocondrial
Numărul de copii ale ADN-ului mitocondrial, normalizat la numărul de copii ale ADN-ului nuclear, nu a diferit semnificativ în ziua 21 între grupurile de dietă HM și MF din ileon sau ficat (Fig. 3). În special, ADNmt a fost
De 2-3 ori mai mare în ficat comparativ cu ileonul.
Numărul de copii ale ADN-ului mitocondrial (ADNmt) în ileonul purceluș de 21 de zile și țesuturile hepatice. A Ziua 21 mtADN (n = 11/grup de dietă) de ileon și b ziua 21 mtADN (n = 11/grup dietetic) de ficat. Valorile ADNmt sunt normalizate la gena beta-actină a ADN-ului nuclear. Datele sunt prezentate ca medie ± SEM. Datele au fost analizate prin testul t cu două cozi pentru a determina semnificația dintre grupurile de dietă. HM - Lapte uman; MF - Formula pe bază de lapte de vacă
Exprimarea genelor selectate relevante pentru metabolism și bioenergetica mitocondrială
Am măsurat expresia genelor pentru transcrieri selectate implicate în funcția mitocondrială și metabolismul din ileon și ficat. În ileon, nu s-au observat diferențe semnificative între grupurile de dietă în ceea ce privește Ubiquinol-Citocrom C Reductază (Uqcr10), Proliferator Peroxisom-Activat Receptor Gamma Coactivator 1-Alpha (Pgc1α), Citocrom C (Cycs), Heat Shock Protein Family A, Membru 9 (Hspa9), p53, factorul respirator nuclear 1 (Nrf1), proteina 1 asociată cu receptorul TNF (capcana 1) și abundențe ale transcriptului mitocondriilor (Tfam) ale factorului de transcripție în ziua 21 (fig. 4a). Interesant este că expresia beta-receptorului activat cu proliferator perilexisom ileon (Pparβ) a fost semnificativ mai scăzută în grupul MF în ziua 21 în raport cu grupul HM, în timp ce expresia proteinei de asamblare a citocromului C oxidază (Sco2) a fost semnificativ mai mare (Fig. 4a). În ficat, abundențele de transcripție p53, Trap1 și Pparβ au fost mai mari la hrana MF în raport cu purceii hrăniți cu HM (Fig. 4b).
Discuţie
Studiul actual al dovezii de principiu care se concentrează asupra țesutului ileal și hepatic al purcelușilor a descoperit noi descoperiri cu privire la dieta sugarilor și funcția mitocondrială a țesuturilor și sugerează că anumite aspecte ale bioenergeticii hepatice sunt modificate de dieta neonatală.
Concluzie
Datele noastre demonstrează că dieta neonatală are impact asupra fenotipurilor bioenergetice mitocondriale hepatice. În plus, în prezența ADP, respirația mitocondrială a fost crescută la purceii MF față de purceii hrăniți cu HM, sugerând că hrana cu formulă a dus la o rotație de ATP hepatică înnăscută mai mare. Sunt necesare studii viitoare pentru a înțelege cum apar diferențele asociate dietei în respirația mitocondrială a țesutului intestinal și dacă există potențiale ramificații pe termen lung în ceea ce privește homeostazia energetică, stresul oxidativ și alte rezultate. În mod clar, trebuie depuse mai multe eforturi pentru a evalua acest model de lucru al efectelor dietei neonatale asupra funcției mitocondriale. Semnalele specifice derivate din dietă sau microbi și/sau semnale gazdă, care reglează activitățile mitocondriale (și relația lor temporală cu perioada neonatală), precum și regiunile intestinale specifice afectate, rămân a fi identificate. În cazul în care efectele dietei sugarilor asupra bioenergeticii descrise aici se recapitulează în țesuturile umane, ar avea implicații profunde în ceea ce privește înțelegerea evenimentelor moleculare fundamentale care diferențiază răspunsurile fiziologice la alăptarea cu formulă și alăptarea.
Disponibilitatea datelor și a materialelor
Toate datele generate sau analizate sunt incluse în articol. Seturile de date utilizate și/sau analizate în timpul studiului actual sunt disponibile de la autorul corespunzător, la o cerere rezonabilă.
- Studiu randomizat al laptelui uman exclusiv versus dietele cu formulă prematură la sugari extrem de prematuri
- Dieta cu restricție de proteine modifică concentrația glicoproteinelor din membrana plasmatică în ficatul de șobolan
- PURINA PRO PLAN True Nature Natural Chicken; Fructe pentru pisici fără grâu de ficat Conserve pentru pisici, 3 oz
- Royal Canin Dieta veterinară Formula calmantă Hrana uscată pentru câini - Animale recunoscătoare
- Dieta veterinară Royal Canin Formula calmantă Hrană uscată pentru pisici 4