Vanessa Las Heras
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
2 Școala de microbiologie, University College Cork, Cork, Irlanda
Adam G. Clooney
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
Feargal J. Ryan
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
Raul Cabrera-Rubio
3 Teagasc Food Research Center, Moorepark, Fermoy, Cork, Irlanda
Pat G. Casey
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
Cara M. Hueston
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
Jorge Pinheiro
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
2 Școala de microbiologie, University College Cork, Cork, Irlanda
Justine K. Rudkin
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
2 Școala de microbiologie, University College Cork, Cork, Irlanda
Silvia Melgar
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
Paul D. Cotter
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
3 Teagasc Food Research Center, Moorepark, Fermoy, Cork, Irlanda
Colin Hill
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
2 Școala de microbiologie, University College Cork, Cork, Irlanda
Cormac G. M. Gahan
1 APC Microbiome Ireland, University College Cork, Cork, Irlanda
2 Școala de microbiologie, University College Cork, Cork, Irlanda
4 School of Pharmacy, University College Cork, Cork, Irlanda
Date asociate
Citirile rrNA 16S brute au fost puse la dispoziție pe SRA sub numărul de acces SRP139708.
Abstract
fundal
Se știe că o dietă occidentalizată care conține un aport caloric ridicat din grăsimi animale influențează dezvoltarea afecțiunilor inflamatorii patologice. Cu toate acestea, sa concentrat relativ puțin asupra implicațiilor unor astfel de diete pentru progresul bolilor infecțioase. Aici, am investigat influența unei diete bogate în grăsimi (HF) asupra parametrilor care influențează infecția cu Listeria monocytogenes la șoareci.
Rezultate
Am stabilit că administrarea pe termen scurt a unei diete HF crește numărul de celule calice, un loc cunoscut de legare pentru agentul patogen, în intestin și, de asemenea, induce modificări profunde ale microbiotei și promovează un profil de expresie genică pro-inflamator la gazdă. Modificările fiziologice ale gazdei au fost concordante cu o sensibilitate crescută semnificativ la infecția orală cu L. monocytogenes la șoarecii hrăniți cu o dietă HF comparativ cu animalele cu conținut scăzut de grăsimi (LF) - sau la hrana animalelor. Înainte de infecția cu Listeria, consumul pe termen scurt al dietei HF a crescut niveluri de Firmicutes, inclusiv Coprococcus, Butyricicoccus, Turicibacter și Clostridium XIVa. În timpul infecției active cu L. monocytogenes, modificările microbiotei au fost în continuare exagerate, dar răspunsurile inflamatorii ale gazdei au fost semnificativ reglate în jos în raport cu grupurile hrănite cu LF sau cu hrana infectată cu Listeria, sugerând o temperare profundă a răspunsului gazdei influențată de infecție în contextul Dieta HF. Efectele dietei au fost observate dincolo de intestin, întrucât o dietă HF a crescut și sensibilitatea șoarecilor la infecția sistemică și a modificat profilurile de exprimare a genelor în ficat.
Concluzii
Am adoptat o abordare sistemică pentru a identifica efectele dietei HF asupra infecției cu L. monocytogenes prin analiza răspunsurilor gazdei și a modificărilor microbiotei (atât pre, cât și post-infecție). În general, rezultatele indică faptul că consumul pe termen scurt al unei diete occidentalizate are capacitatea de a modifica semnificativ susceptibilitatea gazdei la infecția cu L. monocytogenes concomitent cu modificările peisajului fiziologic al gazdei. Constatările sugerează că dieta ar trebui luată în considerare atunci când se dezvoltă modele care reflectă bolile infecțioase ale omului.
Material suplimentar electronic
Versiunea online a acestui articol (10.1186/s40168-019-0621-x) conține materiale suplimentare, care sunt disponibile utilizatorilor autorizați.
fundal
Consumul crescut al unei diete „occidentalizate”, care conține un aport caloric ridicat din grăsimi și un consum redus de fibre fermentabile, a fost legat de pandemia actuală de afecțiuni inflamatorii cronice, cum ar fi obezitatea, diabetul de tip 2, boala inflamatorie intestinală și astmul alergic [1] . O dietă bogată în grăsimi derivate de la animale poate reduce funcția barierei gastrointestinale, compoziția microbiotei gripale și poate altera răspunsurile inflamatorii gastrointestinale și sistemice [1-3]. Astfel de răspunsuri fiziologice profunde în gazdă sunt susceptibile să sprijine modificările patologice, în special la suprafețele mucoasei [1]. Cu toate acestea, potențialul pentru o dietă bogată în grăsimi, occidentalizată, de a influența progresia bolilor infecțioase a primit relativ puțină atenție. Am propus să investigăm acest fenomen folosind Listeria monocytogenes, un agent patogen transmis de alimente care cauzează o boală invazivă gravă (listerioză) la gazdele susceptibile, este din ce în ce mai asociat cu focare mari de surse comune ale bolii și are o rată ridicată a mortalității.
L. monocytogenes a fost investigat pe larg ca model de agent patogen intracelular pentru a descoperi mecanismele biologice implicate în invazia celulelor gazdă, parazitismul intracelular și imunitatea rezultată a gazdei [4]. Majoritatea acestor studii au folosit modele de cultură celulară sau infecție sistemică murină. Cu toate acestea, un număr din ce în ce mai mare de studii au fugit pentru a se concentra asupra fazei gastro-intestinale a infecției. Este clar că agentul patogen poate simți și răspunde atât la semnalele fizico-chimice locale [5-7], cât și la prezența organismelor autohtone [6] în mediul gastro-intestinal, iar adaptarea la mediu poate influența capacitatea agentului patogen de a supraviețui. și se replică tranzitoriu în intestin [5, 7]. Invazia ulterioară a gazdei se realizează prin interacțiunea dintre internalina microbiană A (InlA) și gazda E-cadherină (E-cad), un proces care este cel mai eficient în vecinătatea celulelor calice unde E-cad este mai probabil să fie accesibil [8 ]. În plus, există un rol pentru microbiotă în furnizarea unei bariere la infecție și în modificarea locală a răspunsului imun al gazdei la agentul patogen [6, 9-11].
Am folosit o abordare sistemică pentru a studia efectele unei diete HF asupra unui număr de parametri asociați cu procesul infecțios atât înainte, cât și după infecția cu L. monocytogenes. În special, am examinat atât microbiota, cât și modificările fiziologice ale gazdei, influențate de dietă, atât imediat înainte de infecție, cât și în perioada de vârf a infecției active. Descoperirile noastre indică faptul că o schimbare relativ scurtă a dietei, la o dietă HF occidentalizată, crește susceptibilitatea la infecția orală cu L. monocytogenes concomitent cu un peisaj fiziologic modificat semnificativ atât în tractul gastro-intestinal, cât și în ficat. Mai mult, descoperirile noastre arată că dieta influențează singura faza sistemică a infecției, sugerând o modificare profundă la nivel de sistem a fiziologiei gazdei care modifică susceptibilitatea la infecție.
rezultate si discutii
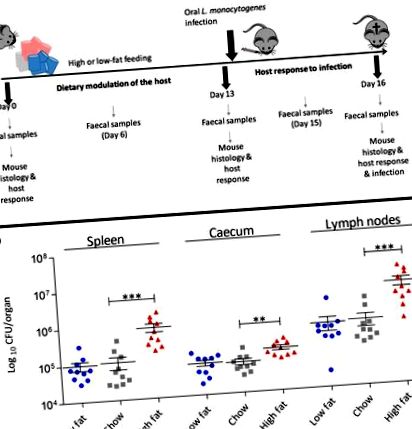
Dieta bogată în grăsimi crește susceptibilitatea la infecția orală cu L. monocytogenes
Modularea dietetică a fiziologiei gazdei înainte de infecție
Se știe că dieta influențează fiziologia gazdei, iar cercetările semnificative s-au concentrat asupra modificărilor asociate cu apariția obezității la șoarecii hrăniți cu o dietă HF [20]. În schimb, relativ puține studii au investigat modificările gastrointestinale sau sistemice care apar înainte de apariția obezității în acest model [21]. Prin urmare, am investigat influența diferitelor diete asupra răspunsului fiziologic al șoarecilor după 2 săptămâni de intervenție dietetică, imediat înainte de infecția orală cu L. monocytogenes. Acesta reprezintă un indice al mediului imediat în care este introdus Listeria și trebuie să stabilească o infecție timpurie. Ne-am concentrat în special asupra parametrilor despre care se știe că joacă un rol în patogeneza L. monocytogenes.
Analiza histologică orbită a indicat o creștere semnificativă a numărului de celule calice intestinale la șoarecii hrăniți cu o dietă HF în raport cu grupurile LF și hrănite cu chow (Fig. 2 a). Datele noastre sugerează un răspuns timpuriu al intestinului la alimentarea cu dietă HF care implică generarea de celule calice și susțin studii anterioare care arată un număr crescut de celule calice asociate cu apariția obezității, deși într-un stadiu mult mai târziu al alimentării dietetice cu IC [22]. Deoarece celulele calicice sunt un sit preferențial de invazie de L. monocytogenes, inclusiv tulpinile L. monocytogenes care exprimă InlA murinizată (modelul utilizat în acest studiu) [8, 16], numărul crescut de celule caliciforme văzut în sistemul nostru este probabil să cel puțin parțial, permite o infecție îmbunătățită.
Transcrierea generală a genelor care codifică proteinele de joncțiune strânsă din ileon a fost redusă la animalele hrănite cu HF comparativ cu alte grupuri. Exprimarea proteinelor de joncțiune strânsă poate fi utilizată ca o evaluare a funcției de barieră și s-a demonstrat anterior că este redusă la șoarecii obezi [34, 35]. Studiile pe termen scurt la rozătoare au demonstrat o reducere a nivelurilor de claudină-7 după 4 săptămâni de dietă HF [36], dar nu au existat modificări ale Zo-1 la 3 zile [37] sau 1 săptămână [35] de hrănire dietetică HF, sugerând timp -alterări dependente pe care le vedem la 2 săptămâni de intervenție dietetică. În cele din urmă, expresia genelor care codifică mN-cad [8] și MET [38], situri de legare cunoscute pentru factorii de invazie L. monocytogenes InlA și InlB în modelul nostru de infecție murin, nu au fost modificate în ileonul șoarecilor hrăniți cu HF, ci au fost semnificativ crescute în ficatul acestor animale în comparație cu grupurile hrănite cu LF sau chow. Gena care codifică E-cad a fost reglată în jos în ileon împreună cu alte proteine de joncțiune epitelială. În ansamblu, am demonstrat modificări semnificative ale mediului gastro-intestinal prin hrănirea pe termen scurt cu HF chiar înainte de infecție în sistemul nostru model, cu multe modificări potențial relevante pentru patogeneza L. monocytogenes.
Dieta HF pe termen scurt modifică microbiota intestinală
Pentru a investiga în continuare orice legături potențiale dintre modificările microbiotei și răspunsul gazdei la hrănirea dietetică, am corelat modificările exprimării genei gazdei cu abundența membrilor individuali ai microbiotei fecale la nivelul genului (Fig. 2 f). Butyricicoccus, Clostridium XIVa, Streptococcus și Mucispirillum au fost mai abundente la șoarecii hrăniți cu o dietă HF, iar abundența lor a fost corelată cu inducerea genelor care codifică răspunsurile inflamatorii ale gazdei. Asocierile dintre aceste genuri și afecțiuni inflamatorii au fost raportate anterior [40, 44]. Parabacteroidele și Bacteroidele au fost relativ mai abundente la șoarecii hrăniți cu LF și au fost raportate anterior că sunt implicate în menținerea homeostaziei imune în intestin și menținerea integrității barierei intestinale [45, 46]. Aici am identificat genuri (de ex. Clostridium XI, Clostridium XIVa, Enterococcus spp.) Care sunt influențate de modificările dietetice ale IC și sunt corelate cu expresia genelor care codifică receptorii pentru L. monocytogenes, precum și genele asociate cu inflamația din ileon și ficat.
Dieta bogată în grăsimi modifică răspunsul fiziologic la infecția cu L. monocytogenes
Corelarea genurilor microbiene cu expresia genei gazdă (Fig. 3 f) evidențiază descreșterea generală a expresiei genei gazdă după infecția cu Listeria în grupul alimentat cu HF. Modificările direcționale la genurile microbiene specifice influențate de dieta HF (Fig. 3 f) au fost similare cu cele observate ca fiind induse doar de dietă (Fig. 2 f). Cu toate acestea, corelațiile cu profilurile asociate de exprimare a genei gazdei au fost în general inversate, indicând faptul că infecția cu L. monocytogenes în contextul dietei HF a fost un modulator negativ semnificativ al genelor gazdă selectate.
Dieta bogată în grăsimi crește susceptibilitatea la infecția sistemică cu L. monocytogenes
În timp ce acest studiu a relevat că dieta singură este un factor determinant al modificărilor fiziologice ale ileonului, a evidențiat, de asemenea, o creștere neașteptată a expresiei genelor care codifică siturile de legare a L. monocytogenes (inclusiv E-Cad, N-Cad, gC1qR) în ficat (Fig. 2 b). De asemenea, am observat modificări ale nivelurilor de expresie ale genelor care codifică citokinele din ficat, care au potențialul de a influența rezistența la infecție, inclusiv o creștere a transcrierii citokinei antiinflamatorii IL-10 la animalele hrănite cu o dietă HF (Fig. 2 b) . Deoarece aceste modificări au avut loc înainte de infecție, am continuat să determinăm influența dietei asupra fazei sistemice a infecției. O infecție intraperitoneală (IP) a L. monocytogenes EGDe m a fost administrată după 2 săptămâni de modulație dietetică (Fig. 4). Rezultatele dezvăluie o influență clară a dietei HF asupra fazei sistemice a L. monocytogenes în comparație cu dietele atât de chow, cât și de LF. Fenomenul a fost observat atât pentru tulpinile EGDe m murinate, cât și pentru tulpinile EGDe de tip sălbatic (Fișa suplimentară 6: Figura S6) de L. monocytogenes, sugerând că acest efect nu se datorează numai unei creșteri a mN-Cad. Datele sugerează că o dietă HF occidentalizată modifică fiziologia gazdei dincolo de intestin pentru a spori susceptibilitatea la boli infecțioase.
Creșterea grăsimilor alimentare crește susceptibilitatea gazdei la infecția sistemică cu L. monocytogenes EGDe m. Sarcina bacteriană a listeriei în splină și ficat la șoareci C57BL/6 hrăniți timp de 13 zile cu diete diferite și infectați ulterior pe ruta IP (n = 10). Abaterea standard de la media, analiza statistică a fost efectuată folosind ANOVA unidirecțională și testul de comparație multiplă al lui Dunnett în raport cu dieta chow. *** p m, a fost centrifugat (7000 × g timp de 5 minute), spălat de două ori cu PBS și resuspendat în PBS. Un inocul de 200 μl cuprindea 3,2 × 10 9 CFU pentru infecția IG și 9 × 10 4 pentru infecția IP. Progresia infecției a urmat pe o perioadă de 3 zile [13, 53], șoarecii menținuți pe dietele lor specifice pentru acea perioadă. Șoarecii au fost eutanasiați, iar organele interne au fost îndepărtate aseptic și omogenizate folosind pungi stomacher și PBS. Pentru enumerarea CFU per organ, diluțiile au fost plasate pe plăci de agar BHI (perfuzie cardiacă cerebrală). După infecția IG, în zilele 14 (ziua 1 postinfecție) și 16 (ziua 3 postinfecție), peletele fecale au fost colectate și placate pentru CFU pentru a determina vărsarea L. monocytogenes.
Extracția ARN și analiza cantitativă RT-PCR
O probă de ficat și ileon au fost colectate pentru analiza răspunsului regulator al gazdei atât la dietă, cât și la infecție (analiza transcriptomului). Probele au fost stabilizate cu RNAlater (Sigma) și depozitate la - 80 ° C până la extracția totală a ARN-ului (RNeasy Plus Universal Mini Kit, Qiagen). ARN-ul total extras a fost tratat cu DNază (TURBO DNA-free ™ Kit, Ambion), iar analiza transcriptomică a fost făcută folosind RT-PCR (Transcriptor Reverse Transcriptase, Roche). Protocolul qPCR a fost realizat utilizând LightCycler® 480 Probes Master (Roche) cu Biblioteca de sonde universale de la Roche. Grundele sunt prezentate în fișierul suplimentar 7: Tabelul S1. Configurarea de amplificare utilizată a fost de 45 de rulări în plăci de 384 de godeuri cu formatul de detectare a sondei de hidroliză MonoColor.
Eșantioane fecale și profilarea microbiotei
Colorarea țesutului și microscopia
analize statistice
Analizele statistice au fost efectuate cu Prism 5 (Graph-Pad Software). Testul Mann-Whitney a fost utilizat pentru a compara mijloacele celor două grupuri. ANOVA unidirecțional cu testul de comparație multiplă al lui Dunnett a fost utilizat pentru compararea perechi a mediilor din mai mult de două grupuri în raport cu controlul, sau cu testul post hoc al lui Tukey pentru compararea mediilor relative la media unui grup de control.
Dacă valoarea p scade peste 0,05, diferențele medii au fost considerate statistic nesemnificative (NS). Pentru diferențe semnificative statistic, * p (306K, pdf)
Figura S1. Compoziția dietei și greutățile murine înainte de infecția orală. (PDF 306 kb)
Figura S2. Creșterea grăsimilor alimentare din surse animale crește susceptibilitatea gazdei la infecția orală cu Listeria monocytogenes EDGe m pIKM2 (PDF 413 kb)
Figura S3. Evaluarea diversității în cadrul eșantionului (alfa diversitate) în grupurile hrănite cu diete bogate în grăsimi sau cu conținut scăzut de grăsimi. (PDF 498 kb)
Figura S4. metrici β-diversitate. (PDF 434 kb)
Figura S5. Scorul histopatologic. (PDF 490 kb)
Figura S6. Creșterea grăsimii alimentare compromite răspunsul imun sistemic al gazdei și crește susceptibilitatea gazdei la infecția IP cu L. monocytogenes EGDe de tip sălbatic. (PDF 355 kb)
Tabelul S1. Seturi de exemple de analiză transcriptomă. (PDF 370 kb)
Mulțumiri
Recunoaștem cu recunoștință asistența tehnică și îndrumarea Kalaimathi Govindarajan, Bhagya Rekha, Anna Golubeva și Jonathan Keane.
Finanțarea
Această cercetare a fost finanțată de Programul de cercetare și inovare Orizont 2020 al Uniunii Europene în temeiul acordului de subvenție Marie Skłodowska-Curie nr. 641984, prin finanțarea consorțiului List_MAPS. Recunoaștem, de asemenea, finanțarea și sprijinul de la Science Foundation Ireland (SFI) sub formă de subvenție de centru (APC Microbiome Ireland grant SFI/12/RC/2273).
Disponibilitatea datelor și a materialelor
Citirile rrNA 16S brute au fost puse la dispoziție pe SRA sub numărul de acces SRP139708.
Contribuțiile autorilor
VLH a efectuat lucrările experimentale, a proiectat experimentele și a analizat datele. VLH și CG au scris lucrarea cu contribuții semnificative de la toți autorii. AC, FR și RR au efectuat analize bioinformatice. PGC și CH au proiectat și efectuat studiile de infecție cu aport semnificativ din VLH. VLH, JP și SM au efectuat analize histologice. JR, SM, PC, CH și CG au conceput și coordonat studiul și au analizat datele. Manuscrisul final a fost citit și aprobat de toți autorii.
Note
Aprobarea eticii și consimțământul de participare
Toate procedurile pentru animale au fost efectuate în acord cu liniile directoare ale Comisiei Europene pentru manipularea animalelor de laborator (Directiva 2010/63/UE), în baza autorizațiilor eliberate de Autoritatea de Reglementare a Produselor de Sănătate (HPRA, Irlanda) pentru utilizarea animalelor în scopuri științifice și aprobat de Comitetul de etică pentru experimentarea animalelor de la University College Cork.
Interese concurente
Autorii declară că nu au interese concurente.
Nota editorului
Springer Nature rămâne neutru în ceea ce privește revendicările jurisdicționale din hărțile publicate și afilierile instituționale.
- Ar trebui să mâncați o dietă bogată în grăsimi pentru un corp cu conținut scăzut de grăsimi
- Deficitul de kinază Per-Arnt-Sim (PASK) crește respirația celulară la o dietă standard și
- Experiența mea cu diete pe termen scurt - CalorieBee - Dietă; Exercițiu
- Cuantificarea translocației Listeria monocytogenes la șobolani prin utilizarea oxidului nitric derivat din urină
- Suplimentarea cu mangan PLOS ONE în căprioare sub o dietă echilibrată crește energia de impact și conținutul