Abhishek Mathur
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Megan Marine
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Debao Lu
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Deborah A. Swartz-Basile
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Romil Saxena
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Nicholas J. Zyromski
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Henry A. Pitt
Departamentul de Chirurgie, Indiana University School of Medicine, Indianapolis IN, SUA
Abstract
Fundal. Obezitatea duce la infiltrarea grăsimilor în mai multe organe, inclusiv inima, rinichii și ficatul. În condiții de stres oxidativ, citokinele derivate din grăsimi sunt eliberate local și duc la un proces inflamator și disfuncție a organelor. În ficat, infiltrarea grăsimilor a fost denumită boală hepatică grasă nealcoolică, care poate duce la steatohepatită nealcoolică. Cu toate acestea, nu sunt disponibile date privind influența obezității asupra grăsimii pancreatice și citokinelor, iar boala pancreasului gras nealcoolic (NAFPD) nu a fost descrisă. Prin urmare, am proiectat un studiu pentru a determina dacă obezitatea este asociată cu creșterea grăsimii pancreatice și a citokinelor. Materiale și metode. Treizeci de control slab C57BL/6J și 30 de șoareci femele obezi cu deficit de leptină au fost hrăniți cu o dietă de 15% grăsime timp de 4 săptămâni. La vârsta de 12 săptămâni, toate animalele au suferit pancreatectomie totală. Pancreata din fiecare tulpină a fost combinată pentru măsurarea a) greutății umede și uscate, b) prezenței histologice a grăsimilor, c) trigliceridelor, acizilor grași liberi (FFA), colesterolului, fosfolipidelor și grăsimilor totale și d) interleukinei (IL) - 1β și factorul de necroză tumorală-alfa (TNF-α). Datele au fost analizate prin testul t Student și testul exact al lui Fisher. Rezultate. Pancreata de la șoareci obezi a fost mai grea (p Cuvinte cheie: Citokine, grăsimi, obezitate, pancreas
Introducere
Obezitatea a devenit epidemică în Statele Unite, peste 50.000.000 de americani având un indice de masă corporală (IMC)> 30 1. Obezitatea duce la multiple comorbidități, inclusiv diabet, hipertensiune și hiperlipidemie (sindromul metabolic). În plus, obezitatea provoacă infiltrarea grăsimilor în mai multe organe, inclusiv inima, rinichii și ficatul. În condiții de stres oxidativ, citokinele derivate din grăsimi sunt eliberate local și duc la un proces inflamator și disfuncție a organelor. În ficat, infiltrarea grăsimii a fost denumită boală hepatică grasă nealcoolică (NAFLD), care poate duce la steatohepatită nealcoolică (NASH) 2, 3. În plus, țesutul adipos a fost caracterizat ca un organ endocrin cu producție crescută de adipokine, inclusiv leptină și adiponectină, și citokine cum ar fi factorul de necroză tumorală alfa (TNF-α), interleukina-6 (IL-6) și proteina chimiotactică monocitară -1 (MCP-1) 4. La rândul lor, macrofagele produc IL-1β și mieloperoxidază (MPO), care exacerbează și mai mult procesul inflamator 4, 5 .
În 1920, Schaefer a raportat o corelație între greutatea pancreasului adult și greutatea corporală 6. În 1933, Ogilvie a găsit 9% grăsime pancreatică la cadavrele slabe, comparativ cu 17% grăsime pancreatică la cadavrele obeze 7. În anii 1960 și 1970, grăsimea din pancreas (lipomatoza pancreatică) a fost corelată cu vârsta, obezitatea și diabetul de tip 2 8, 9. Studiile recente de tomografie computerizată (CT) și imagistica prin rezonanță magnetică (RMN) au corelat și grăsimea pancreatică cu obezitatea 10, 11, 12. Observațiile umane sugerează în plus că severitatea pancreatitei este crescută la pacienții obezi 13, 14. În ciuda acestor observații, boala pancreatică grasă nealcoolică (NAFPD) și steatopancreatita nealcoolică (NASP) nu au fost descrise.
Materiale și metode
Animale și diete
Treizeci de control slab (C57BL/6J) și 30 de șoareci femele obezi cu deficit de leptină (Lep ob) au fost obținuți de la Laboratorul Jackson (Bar Harbor, ME, SUA). Șoarecii Lep ob sunt cunoscuți ca având hiperplazie de celule insulare, diabet de tip II și glucoză și insulină serice crescute, sugerând insuficiență endocrină pancreatică 15, 16 Șoarecii au fost adăpostiți câte cinci pe cușcă într-o cameră controlată cu lumină (6 am până la 6 pm) și temperatură (22 ° C). Pe parcursul unei săptămâni de ajustare a mediului, șoarecii au fost hrăniți cu o dietă standard de chow cu conținut scăzut de grăsimi (Ralston Purina, St Louis, MO, SUA). La vârsta de 8 săptămâni, toți șoarecii C57BL/6J slabi și femele cu șobolan cu deficit de leptină (Lep ob) au fost hrăniți cu o dietă cu conținut scăzut de grăsimi (15% grăsimi, 45% carbohidrați și 40% proteine) (Dyets Inc., Bethlehem, PA, SUA) timp de 4 săptămâni. Grăsimea era grăsime anhidră din lapte; carbohidrații au fost 35% zaharoză și 10% amidon de porumb; iar proteina a fost cazeină. Ambele animale și mâncarea au fost cântărite săptămânal pentru a determina creșterea și aportul alimentar. Toate protocoalele pentru aceste studii pe animale au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor din Universitatea Indiana.
Colectarea serului și a țesuturilor
La vârsta de 12 săptămâni, după un post peste noapte cu apă permisă ad libitum, șoarecii au fost sedați cu un tifon îmbibat cu izofluran pus într-un borcan de sticlă de 2000 cm 3. Au fost apoi anesteziați cu o injecție intraperitoneală de xilazină (15 mg/kg) și ketamină (50 mg/kg). Animalele au fost cântărite și apoi supuse laparotomiei și pancreatectomiei totale. O felie de țesut din opt pancreas dorsal din fiecare tulpină a fost plasată în formalină pentru a măsura prezența histologică a grăsimii, inflamației și fibrozei. Șapte pancreas din fiecare tulpină au fost utilizate pentru măsurarea greutăților umede și uscate. Șaisprezece pancreas dorsal din fiecare tulpină au fost grupate câte două pe grup și au fost congelate la -80 ° C pentru măsurarea trigliceridelor, acizilor grași liberi (FFA), colesterolului, fosfolipidelor și grăsimilor totale. Șapte pancreas dorsal din fiecare tulpină au fost înghețate rapid la -80 ° C pentru măsurarea citokinelor IL-1β și TNF-α. Sângele întreg a fost aspirat din inimă și centrifugat pentru a izola serul.
Analiza histologică
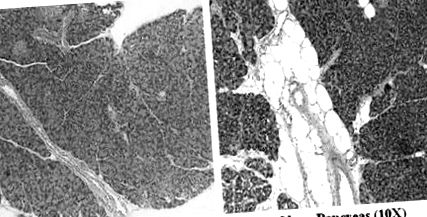
Specimenele pancreatice fixate în formalină au fost colorate cu hematoxilină și eozină și au fost examinate de un observator care a fost orbit în ceea ce privește grupurile. Fiecare specimen a fost clasificat, în cinci câmpuri de mare putere, de la 0 la 4+ pentru grăsime inter- și intralobulară, inflamație și fibroză. Scorul total al grăsimii pancreatice a fost calculat ca o sumă a grăsimii inter- și intralobulare. Figura 1 A, B prezintă un pancreas tipic de la un șoarece slab și, respectiv, obez.
(A) histologie pancreatică tipică (A) a unui șoarece slab și (B) a unui șoarece obez (mărire originală × 10).
Analiza serului
Sângele integral a fost rotit la 15.000 rpm timp de 5 minute pentru a separa serul. Serul a fost combinat pentru a da șase bazine pentru șoareci slabi și cinci bazine au fost obținute pentru șoareci obezi. Colesterolul seric și trigliceridele au fost determinate utilizând o metodă colorimetrică enzimatică pentru determinarea cantitativă a acestora. Trusele pentru aceste măsurători au fost obținute de la Wako Chemicals USA, Inc., Richmond, VA, SUA și Stanbio Labs, Boerne, TX, SUA.
Analiza lipidelor vezicii biliare
Lipidele vezicii biliare de la opt bazine de la șoareci slabi și obezi au fost supuse unei analize lipidice la Centrul de Fenotipare Metabolică a Șoarecilor din Centrul Medical al Universității Vanderbilt, așa cum a fost descris anterior de Goldblatt și colab. 17. Pe scurt, lipidele au fost extrase prin metoda Folch-Lees 18. Clasele individuale de lipide au fost separate prin cromatografie în strat subțire folosind plăci de silicagel 60 A și vizualizate cu rodamină 6G. În plus, colesterolul total a fost analizat prin metoda lui Rudel și colab. 19. O alicotă din extractul Folch a fost saponificată cu KOH 1 N în metanol 90%. Sterolul nonsaponificabil a fost extras folosind hexan, iar colesterolul total a fost determinat prin cromatografie gazoasă.
Analiza citokinelor
Citokinele IL-1β și TNF-α au fost măsurate în șapte pancreas din fiecare tulpină prin utilizarea tehnicii cantitative de imunoanaliză a enzimei sandwich. Kitul ELISA în acest scop a fost obținut de la R&D Systems, Inc. (Minneapolis, MN, SUA).
analize statistice
Valorile sunt media ± SEM.
* p † p Figura 6. Ambele citokine au fost semnificativ crescute la obezi comparativ cu șoarecii slabi (p ob) șoarecii femele au fost hrăniți cu o dietă scăzută (15%) cu grăsimi timp de 4 săptămâni. Pancreasul șoarecilor obezi era mai greu decât cel al omologilor lor slabi. La examenul histologic, grăsimea pancreatică intralobulară și totală a crescut semnificativ la șoarecii obezi. Colesterolul seric, dar nu și trigliceridele, a fost crescut la șoarecii obezi. Analiza lipidelor pancreatice a dezvăluit o creștere semnificativă a grăsimilor totale, a trigliceridelor și a FFA, precum și a crescut semnificativ colesterolul la șoarecii obezi. Nu s-au observat diferențe de tulpină la nivelurile de fosfolipide pancreatice. Lanțurile de acizi grași saturați 14:00 și 16:00 au crescut de cinci ori la șoarecii obezi; Ora 18:00 a fost mărită de 2,5 ori la șoarecii obezi. Acizii grași nesaturați care au fost crescuți de peste patru ori la șoarecii obezi au inclus 16:01, 18:01, 18:02 și 18: 3w3. Citokinele IL-1β și TNF-α au fost, de asemenea, semnificativ crescute în pancreasul șoarecilor obezi.
De când Ogilvie 7 a postulat pentru prima dată entitatea infiltrării de grăsime pancreatică, tehnici radiologice mai sofisticate au susținut această afirmație 10, 11, 12. Interesant este că grăsimea din pancreas nu este distribuită omogen în toată glanda 10. Matsumoto și colab. a propus o clasificare a infiltrării de grăsime pancreatică bazată pe economisirea grăsimii în aspectul posterior al capului pancreasului, uncinatului și a zonei din jurul căii biliare comune. Diferențele în dezvoltarea embriologică a mugurilor pancreatici ventral și dorsal au fost propuse ca fiind cauza 10. Alte îmbunătățiri ale procesului de cuantificare a grăsimilor au venit cu RMN. Folosind tehnica Dixon în 3 puncte, Kovanlikaya și colab. au reconfirmat corelația IMC și a grăsimii pancreatice 12 .
Infiltrarea crescută a grăsimilor în pancreas a fost asociată cu obezitatea, vârsta crescută, sindromul Cushing, fibroza chistică și pseudohipertrofia lipomatoasă 7, 8, 20. Dreiling și colab. a postulat că infiltrarea de grăsime a pancreasului a fost un proces reversibil 21. În plus, Nghiem și colab. au arătat că pancreasul gras observat la obezitate poate fi „degresat” și utilizat cu succes pentru transplantul de pancreas 22. Cu toate acestea, înlocuirea grasă extremă a pancreasului exocrin este probabil asociată cu o scădere a funcției pancreatice. Înlocuirea masivă a grăsimilor a fost descrisă în entitatea pseudohipertrofiei lipomatoase a pancreasului 9, 20. Interesant este faptul că celulele insulelor pancreatice sunt rezistente la infiltrarea grasă 9, 20 .
Obezitatea duce la NAFLD, care poate evolua către NASH, ciroză și, în cele din urmă, cancer hepatocelular 2, 3. Obezitatea și, în mod important, obezitatea centrală, au fost, de asemenea, asociate cu un risc semnificativ crescut de cancer pancreatic 42. Creșterea grăsimii pancreatice și, în special a FFA, poate juca un rol în progresia NASP către cancer. În sprijinul acestei ipoteze, sa demonstrat că o dietă bogată în grăsimi sporește riscul de cancer pancreatic atât la modelele umane, cât și la cele animale 43, 44. Ghadrian și colab. și Stolzenberg și colab. De asemenea, au raportat că aportul crescut de grăsimi saturate din dietă crește riscul de cancer pancreatic 45, 46. În plus, Fisher și colab. a arătat că creșterile serice ale FFA se corelează atât cu creșterea tumorilor in vivo cât și in vitro 47. În plus, au arătat că acidul linoleic și oleic determină o creștere dependentă de doză a creșterii celulelor pancreatice. Ambii acizi grași au fost crescuți în pancreasul șoarecilor obezi din studiul nostru. Cu toate acestea, vor fi necesare studii suplimentare pentru a determina dacă șoarecii obezi congenital cu creșterea grăsimii pancreatice sunt mai predispuși la cancer pancreatic.
Acest studiu documentează că șoarecii obezi au pancreas mai greu și mai multă grăsime pancreatică, în special trigliceride și FFA, precum și citokine crescute. Concluzionăm că obezitatea duce la infiltrarea de grăsime a pancreasului, care poate fi numită boală pancreatică grasă nealcoolică. Această observație poate avea implicații în ceea ce privește severitatea pancreatitei la pacienții obezi, precum și asocierea obezității cu cancerul pancreatic. Astfel, acumularea de grăsimi toxice și citokine proinflamatorii în pancreas, steatopancreatită, poate fi cheia patogeniei atât a pancreatitei, cât și a cancerului pancreatic.
Mulțumiri și dezvăluiri
Acest studiu a fost susținut de grantul NIH R-01 DK44279.
- Compusul natural din legume ajută la combaterea bolilor hepatice grase EurekAlert! Știri științifice
- S-a identificat o cale posibilă de semnal în lupta împotriva bolilor de ficat gras legate de obezitate
- Oamenii de știință mai aproape de rezolvarea misterului de ce oamenii slabi suferă de boli de ficat gras
- Obezitatea și bolile renale au ascuns consecințele epidemiei Future Science OA
- Studiu nou; Cinci obiceiuri sănătoase; Pentru dietă, exerciții fizice, IMC, fumat; Alcool; Boala cronică inferioară,