Abstract
Obezitatea a fost asociată cu o expresie anormal de ridicată a enzimei aromatază în sân, creșterea producției locale de estrogen și predispoziția la hiperplazie mamară și cancer. Adipozitatea crescută la femeile aflate în postmenopauză poate declanșa căi de semnalizare care induc expresia aromatazei. În fibroblastele adipoase mamare, producția crescută de TNF poate induce promotorul distal de aromatază, în timp ce producția locală crescută de PGE2 poate induce regiunea promotorului proximal. Revizuim aici mecanismele care controlează expresia genei aromatazei în țesutul adipos al sânului și interacțiunile paracrine dintre celulele epiteliale mamare maligne și fibroblastele adipoase din jur. Caracterizarea sistematică a acestor căi de semnalizare va facilita identificarea potențialelor ținte medicamentoase pentru a reduce selectiv expresia aromatazei și producția excesivă de estrogen, cu beneficii terapeutice.
Relația dintre obezitate și estrogen
La nivelul sânului, celulele epiteliale benigne sau maligne se află în contact cu capilarele căptușite cu celule endoteliale, fibroblastele adipoase nediferențiate, cunoscute și sub numele de preadipocite și adipocitele mature umplute cu lipide [17]. Aromataza, un membru al superfamiliei citocromului P450, este enzima responsabilă de etapele cheie în sinteza estrogenilor [9]. Aromataza este exprimată în mai multe țesuturi, inclusiv fibroblaste adipoase nediferențiate și tumori mamare, dar nu este exprimată în adipocite mature [9,18]. O masă mult crescută de țesut adipos mamar la femeile obeze poate crește local producția de estrogen în sân, pur și simplu din cauza unui număr mai mare de fibroblaste care exprimă aroma tazei [9]. În plus față de acest efect de masă, expresia aromatazei pe unitate de țesut adipos sau celulă poate crește, de asemenea, odată cu creșterea în greutate.
Estrogenul, un produs al enzimei aromatazei din țesutul adipos, a fost suspectat de mult timp ca hormonul responsabil pentru creșterea riscului de cancer mamar la femeile obeze aflate în postmenopauză. De fapt, cel mai eficient tratament hormonal al cancerului de sân postmenopauză a fost utilizarea inhibitorilor aromatazici care blochează activitatea aromatazei în sân și periferie, reducând astfel cantitatea de producție locală de estrogen - care, la rândul său, ajută la suprimarea recurenței țesutul tumoral al sânului [19]. O problemă esențială și nerezolvată a fost contribuția relativă a țesutului adipos al sânului, comparativ cu țesutul adipos subcutanat la alte zone ale corpului, la formarea estrogenului care contribuie la creșterea riscului și creșterii cancerului mamar. Studiile epidemiologice au sugerat că nivelurile ușor crescute de estrogen din sânge venos ar putea reprezenta o parte a legăturii dintre obezitate și incidența cancerului de sân [20]. Cu toate acestea, studiul randomizat al inițiativei de sănătate a femeilor, efectuat recent, demonstrând o posibilă reducere a riscului de cancer mamar la femeile aflate în postmenopauză cărora li s-a administrat înlocuire hormonală numai estrogenă, a contestat rolul nivelurilor ușor crescute de estrogen circulant în riscul de cancer mamar [15,16].
Mecanisme de supraexprimare a aromatazei în cancerul de sân care răspunde la estrogeni
O singură genă codifică aromataza, enzima cheie pentru biosinteza estrogenului, a cărei inhibare elimină în mod eficient producția de estrogen. Astăzi, inhibitorii aromatazei sunt cele mai eficiente tratamente endocrine pentru cancerul de sân care răspunde la estro-xsgen [28]. Mai multe studii clinice randomizate cap la cap publicate din 2000 au demonstrat superioritatea inhibitorilor de aromatază față de antagonistul estradiolului tamoxifen în tratamentul cancerului de sân [19,29-35]. Astfel, inhibarea formării estrogenului este terapeutic mai eficientă decât blocarea acțiunii sale. Ovarele, testiculele, țesutul adipos, pielea, hipotalamusul și placenta, toate exprimă aromatază, fiziologic [36]. În schimb, țesutul adipos al sânului care poartă o tumoare supra-exprimă aromataza, ducând la o supraproducție locală de estrogen care exercită efecte tumorigene paracrine și intracrine [36]. Deși regiuni promotore similare ale aromazei pot fi activate în țesuturile normale și patologice, mecanismele de reglare celulară și transcripțională sunt extrem de diverse și specifice celulei [9,37]. Acest lucru a condus la o investigație detaliată a mecanismelor care stau la baza supraexprimării aromatazei în fiecare țesut într-un efort de a defini ținte moleculare specifice pentru dezvoltarea de noi terapii [9,38].
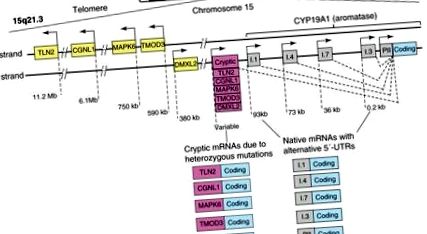
Promotori utilizați alternativ, distribuiți într-o regiune de reglare de 93 kb în amonte de o regiune comună de codificare, controlează expresia aromatazei în mod diferit în gonade, țesut adi-pus, os, creier, piele, ficat fetal și placentă [39]. Până în prezent, la om au fost găsiți zece promotori alternativi, inclusiv I.1, I.2 în placentă, I.4 în țesutul adipos și piele, I.5 în țesuturile fetale, Dacă în creier, I.7 în celulele endoteliale, I.6 în os, I.3 în țesutul adipos și PII în gonade (Figura 1) [9]. Un set distinct de factori de transcripție reglează fiecare promotor într-o manieră de semnalizare specifică și țesut specific.
Structura genei CYP19A1. Gena umană CYP19A1 (aromatază) este transcrisă în direcția de la telomer la centromerul cromozomului 15 și conține aproximativ 10 promotori nativi folosiți alternativ, care îi reglează expresia parțial specific țesutului. Activarea fiecărui promotor transcrie pe specii de ARNm care conține o regiune specifică 5'-netradusă (5'-UTR), care servește ca semnătură a promotorului respectiv. Alte cinci gene (TLN2, CGNL1, MAPK6, TMOD3 și DMXL2) grupate în ordine tandem se află lângă aromatază la aspectul său telomeric. Inversiunile sau delețiile heterozigoice schimbă direcția promotorilor acestor gene și a 5’-UTR-urilor lor și le mută în amonte de gena aromatazei. Acești promotori criptici supraexprimă în mod necorespunzător aromataza în mai multe țesuturi umane și provoacă exces de estrogen. Cea mai frecventă manifestare este creșterea feminină a țesutului mamar la băieții tineri (ginecomastie prepubertală) (vezi [40] pentru detalii suplimentare).
Hormonul foliculostimulant (FSH) induce cel mai proximal promotor PII printr-o cale dependentă de AMPc care implică recrutarea factorului 1 steroidogen și a β-cateninei în celulele granuloase ovariene umane [41]. După cum se va detalia mai târziu, PGE2 prin AMPc induce în mod coordonat grupul proximal de promotori PII și I.3, care se află într-o secvență de aproximativ 0,2 kb, prin recrutarea CCAAT/proteinei de legare a amplificatorului β (C/EBPβ), JunD și ficat receptor homolog-1 (LRH-1), în fibroblastele adiposi de sân uman [9,42]. Prin contrast, promotorul I.4 care se află la aproximativ 73 kb în amonte de regiunea de codificare este indus de gluco-corticoizi și citokinele interleukină -6 sau -11 și TNF. Acest lucru duce la activarea kinazei c-iunie N-terminale (JNK) care activează kinaza-1 (Jak1) și la recrutarea traductorului de semnal și a activatorului transcripției-3 (STAT3), împreună cu receptorul glucocorticoid (GR), în fibroblaste adipoase umane [9]. În țesutul mamar fără cancer, fibro-blastele adipoase exprimă niveluri scăzute de aromatază prin intermediul promotorului I.4, în timp ce regiunea promotorului I.3/II, care este ocupată de represori transcripționali, rămâne în repaus [43,44].
Mecanismele celulare și moleculare distincte sunt responsabile pentru exprimarea aromatazei în cancerul de sân față de țesutul mamar fără boală [9]. În primul rând, compoziția celulară este modificată în cancerul de sân, astfel încât fibroblastele adipos nediferențiat care exprimă aromatază se acumulează în jurul celulelor epiteliale maligne. În al doilea rând, modificările moleculare ale celulelor stromale adipoase favorizează legarea amplificatorilor transcripționali față de inhibitori la regiunea I.3/II a promotorului normal de aromatază în repaus. Lucrările efectuate de mai multe laboratoare au sugerat că aceste două mecanisme susțin supraexpresia aromatazei locale în cancerul de sân și numărul de ac pentru majoritatea expresiei aromatazei în cancerul de sân [24,45,46]. A fost descris un al treilea mecanism și implică o activitate crescută a regiunilor promotorului distal, cum ar fi I.4 și I.7, și acest lucru contribuie, de asemenea, la supraexprimarea aromatazei în tumorile mamare (Figura 1) [47,48]. În cele din urmă, mutațiile heterozigote, care determină regiunea de codificare a aromatazei să se afle adiacent promotorilor criptici activi constitutivi care transcriu în mod normal alte gene, pot contoriza supraexpresia aromatazei în sân și alte țesuturi și formarea excesivă de estrogen (Figura 1) [49]. Semnificația clinică a acestui mecanism în dezvoltarea cancerului nu este încă cunoscută.
Formarea de estrogeni în cancerul de sân
Estrogenul biologic activ este estradiolul. Aromataza catalizează conversia androstendionei în estronă sau testosteron în estradiol. Deoarece principalul steroid precursor circulant la femeile aflate în postmenopauză este androsten-diona, enzimele reductive sunt necesare pentru formarea estradiolului. Enzimele 17β-hidroxisteroid dehidrogenază tip 1 (HSD17B1) și aldo - ceto reductaza familiei 1, membru C3 (AKR1C3), care pot transforma estrona în estradiol și, respectiv, an-drostenedionă în testosteron, sunt prezente în diferite tipuri de celule maligne și benigne țesuturile mamare și activitatea aromatazei complementare pentru formarea estradiolului din androstendionă circulantă (Figura 2) [58,59].
Localizarea celulară a aromatazei în cancerul de sân
Aproximativ 90% din activitatea enzimei aromatazei și ARNm în țesutul adipos mamar se găsește în fibroblaste nediferențiate, mai degrabă decât în adipocite mature [60] (Figura 2). Aromataza imunoreactivă a fost localizată atât la celulele epiteliale maligne, cât și la fibroblastele înconjurătoare în țesuturile tumorale mamare [61-63]. Cu toate acestea, relevanța biologică a aromatazei imunoreactive detectată de diferite anti-matrițe a rămas discutabilă [64]. Niveluri semnificativ ridicate de activitate enzimatică aromatază și expresie genică prin activarea promotorului I.3/II au fost detectate în mod constant în țesutul adipos mamar sau fibroblaste, proaspăt izolate din țesutul mamar, cu sau fără cancer [24,60,65]. Activitatea enzimei aromatazice în celulele epiteliale mamare primare sau linii celulare, în schimb, a fost fie nedetectabilă, fie extrem de scăzută [66] (Figura 2).
Stratul dens de fibroblaste adipoase nediferențiate (reacție desmoplastică) care înconjoară celulele epiteliale maligne este esențial pentru susținerea structurală și biochimică a creșterii tumorale [67]. Celulele epiteliale maligne secretă cantități mari de citokine antiadipogene TNF și IL-11, care inhibă diferențierea fibroblastelor de adipocite mature în principal prin suprimarea factorilor de transcripție adipogenă C/EBPα și a proliferatorului peroxizomului-receptorul activat-γ (PPARγ ) (Figura 2). Astfel, un număr mare de fibroblaste adipoase producătoare de estrogen sunt menținute în proximitate cu celulele maligne [43,68] (Figura 2).
Căi de semnalizare care reglează regiunea promotor I.3/II la fibroblastele tumorilor mamare
Pentru a investiga potențialele mecanisme de blocare a activității aro-matazice și a producției de estrogen în fibroblastele adipoase mamare care înconjoară celulele epiteliale maligne, efectorii din aval ai căii PGE2 - cAMP - PKA/PKC au fost studiați sistematic [27]. Aceste eforturi au ajutat la definirea componentelor de semnalizare care conectează factorii de transcripție legați de regiunea promotorului tumorigenic I.3/II al genei aromatazei. Studiile asupra fibroblastelor adipoase au indicat implicarea kinazelor MAP termospecifice: JNK și p38 (Figura 3) [27]. Disecția detaliată a acestei căi a indicat faptul că tratamentul cu PGE2 al fibroblastelor adipoase mamare a activat atât PKA cât și PKC și efectorii lor din aval, JNK și p38, care în mod colectiv erau necesare pentru producția de estro-gen mediată prin regiunea promotor I.3/II a genei aromatazei [27]. Aceste studii au evidențiat rolul acestor kinaze MAP terminale în activarea expresiei genei aromatazei și au subliniat posibilitatea utilizării JNK și p38 ca potențiale noi ținte medicamentoase pentru ablația specifică a țesutului mamar a expresiei aromatazei.
Complexe transcripționale care reglează regiunea promotorului I.3/II în fibroblastele tumorilor mamare
Promotorii I.3 și II sunt situați la o distanță de aproximativ 0,2 kb și împărtășesc mai multe elemente cu acțiune cis necesare activării promotorului, incluzând o jumătate de situs de receptor nuclear, situsuri de legare C/EBPβ, situsuri de legare AP-1 și cAMP elemente de răspuns (CRE) (Figura 3) [43,44]. A fost raportat un număr mare de factori de transcripție, care ar putea regla această regiune complexă. Cu toate acestea, s-a demonstrat că foarte puține dintre acestea au un rol funcțional în fibroblastele adipoase umane. În această revizuire ne concentrăm pe potențiatori de transcripție care au fost caracterizați folosind tehnici in situ, cum ar fi imunoprecipitarea prin cromatină PCR, sau s-a dovedit că reglează activitatea ARNm de aromatază sau enzimă folosind tehnici de knockdown bazate pe siARN în fibroblaste adipose umane primare. Acești factori sunt limitați la C/EBPβ, proteina care leagă CREB (CBP), receptorul hepatic omolog 1 (LRH-1), JunB și JunD [42,44,72-79].
S-a arătat că incubația fibroblastelor adipoase mamare cu mediu condiționat de celule epiteliale maligne sau cu PGE2 duce la recrutarea unui complex transcripțional stimulator, cuprinzând C/EBPβ, CBP, JunB, JunD și LRH-1, către promotorul de aromatază I. 3/Regiunea II [44,72-79] (Figura 3). Astfel, în fibroblastele adipoase nediferențiate din tumorile mamare, promotorii de aromatază grupați proximal I.3/II sunt reglementați coordonat de mecanismele dependente de PKA și PKC (Figura 3). Așa cum s-a menționat mai sus, acești promotori sunt de obicei în repaus în fibroblaste ale țesutului mamar normal datorită legării unui complex inhibitor transcripțional. Într-un mediu mamar malign, cu toate acestea, regiunea promotor I.3/II este ocupată de mai mulți potențiatori de transcripție ca urmare a activării mai multor căi de semnalizare care, în cele din urmă, măresc expresia aro-matază în fibroblastele mamare [43,44] (Figura 3 ).
Țintirea regiunii promotorului de aromatază I.3/II ca strategie terapeutică
Concluzii finale
Mulțumiri
Munca noastră este susținută de subvenții de la Institutul Național al Cancerului (CA67167), Fundația Avon și Fundația Lynn Sage.
- Cancerul de sân îi afectează și pe bărbați. Aveți grijă la orice nod în axilă, gât; persoanele cu diabet zaharat, obezitate
- Cancer de sân Obezitatea poate împiedica unele tratamente
- Rezumat P4-10-15 Obezitatea influențează caracterul cancerului de sân la femeile aflate în postmenopauză
- Acupunctura și psihoterapia în tratamentul complex al obezității Acupunctura medicală
- AEG-1MTDHLYRIC Un partener proteic promiscu critic în cancer, obezitate și boli ale SNC - PubMed